染色体6q24q25領域に位置する遺伝子(PEX3、PLAGL1、HYMAI、STX11、EPM2A、GRM1、SYNE1、ARID1B、SERAC1、RSPH3)に関連する稀少疾患について、原因、症状、診断方法、治療法を詳しく解説します。
この記事のまとめ
本記事では、6q24q25領域に位置する重要な遺伝子とその異常に関連する稀少疾患について詳しく紹介します。それぞれの遺伝子が引き起こす病態、臨床症状、診断方法、そして治療の現状を分かりやすく解説。希少疾患の理解を深め、適切なサポートと治療への一歩を提供します。
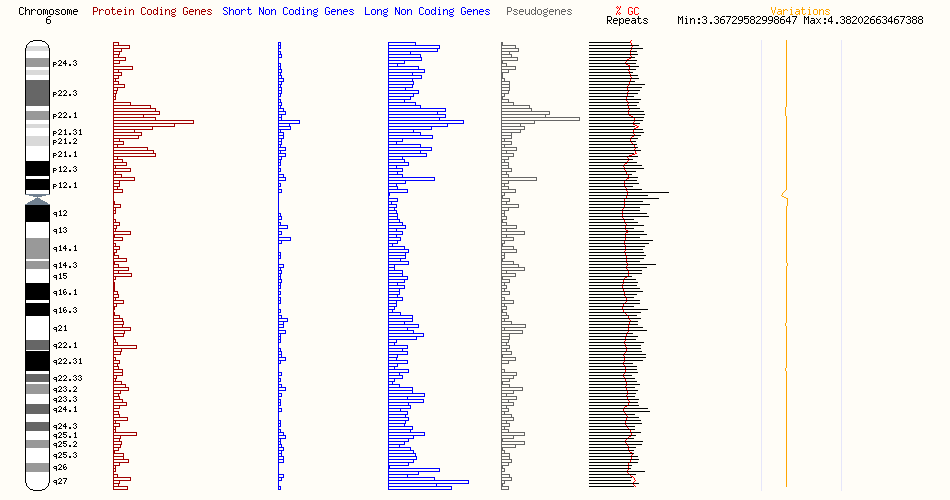
この遺伝子座にある疾患に関与する可能性が高い遺伝子

| S/N | 遺伝子名 | 関連疾患 | Associated disease description(s) |
| 1 | PEX3 | ゼルウィガースペクトラム障害 | Zellweger Spectrum Disorder |
| 2 | PLAGL1 | 糖尿病、6q24関連一過性新生児 | 6q24-Related Transient Neonatal Diabetes Mellitus |
| 3 | HYMAI | 糖尿病、6q24関連一過性新生児 | 6q24-Related Transient Neonatal Diabetes Mellitus |
| 4 | STX11 | 家族性血球貪食性リンパ組織球症 | Familial Hemophagocytic Lymphohistiocytosis |
| 5 | EPM2A | 進行性ミオクローヌスてんかん、ラフォラ型 | Progressive Myoclonus Epilepsy, Lafora Type |
| 6 | GRM1 | 遺伝性運動失調症(自律劣性小脳失調症13型) | Hereditary ataxia (SpinoCerebellar Ataxia, autosomal Recessive 13) |
| 7 | SYNE1 | SYNE1欠損症 | SYNE1 Deficiency |
| 8 | ARID1B | ARID1B関連疾患;先天性横隔膜ヘルニア:コフィン・シリス症候群 | ARID1B-Related Disorder; Congenital Diaphragmatic Hernia; Coffin-Siris Syndrome |
| 9 | SERAC1 | 難聴、脳症、リー様症候群を伴う 3-メチルグルタコン酸尿症 | 3-methylglutaconic aciduria with deafness, encephalopathy, and Leigh-like syndrome (MEGDEL) |
| 10 | RSPH3 | 原発性繊毛運動障害 32 | Primary Ciliary Dyskinesia 32 (CILD32) |
[1_PEX3] Zellwegerスペクトラム障害(Zellweger Spectrum Disorder)


ペルオキシソーム生合成因子3(Peroxisomal biogenesis factor 3)をコードするPEX3遺伝子の変異は、Zellwegerスペクトラム障害(Zellweger Spectrum Disorder, ZSD)を引き起こす原因の一つとして広く知られています。この遺伝子は染色体の6q24-q25領域に位置しており、ペルオキシソームという細胞内小器官の形成やその膜構造の維持において重要な役割を果たしています。ペルオキシソームは脂肪酸の分解や有害物質の解毒に関与するため、細胞の正常な機能に欠かせない存在です。

PEX3遺伝子がコードするタンパク質は、ペルオキシソーム膜タンパク質を輸送する際に、PEX19というタンパク質の「ドッキング因子」として機能します。また、ペルオキシソーム内部(マトリックス)にタンパク質を輸送する前段階として、膜小胞を組み立てる役割も担っています。このように、PEX3はペルオキシソームの形成と機能を支える中心的な役割を果たしており、この機能が損なわれることでペルオキシソーム生合成障害補完群12(Peroxisome biogenesis disorder complementation group 12, PBD-CG12)の病態が生じます。
PBD-CG12は、ペルオキシソーム膜や内部(マトリックス)へのタンパク質輸送が障害されることで、ペルオキシソームの機能に異常をきたす疾患です。この疾患は、ペルオキシソーム生合成障害(PBD)という遺伝的に多様な疾患グループの一部に属しています。PBDは少なくとも14の異なる遺伝グループに分類されており、その代表的な疾患にはZellweger症候群(Zellweger syndrome, ZWS)、新生児型副腎白質ジストロフィー(neonatal adrenoleukodystrophy, NALD)、乳児型Refsum病(infantile Refsum disease, IRD)、およびリゾメリック点状軟骨異形成(rhizomelic chondrodysplasia punctata, RCDP)があります。ZWS、NALD、IRDの3つは互いに関連性があり、Zellwegerスペクトラム(PBD-ZSS)と呼ばれる連続した臨床的特徴を形成しています。一方、RCDPは異なる疾患群に属します。

PEX3遺伝子の機能喪失は、Zellwegerスペクトラム障害の一種であるPBD10A(Peroxisome biogenesis disorder 10A)も引き起こします。この疾患は、神経系の重度な機能障害(精神運動発達遅滞や筋緊張低下、新生児けいれん)、特徴的な頭蓋顔面異常、肝臓機能の障害、およびペルオキシソームの欠如を伴います。さらに、心血管や骨格の異常、腎嚢胞、視覚障害や聴覚障害が見られる場合もあります。特に重症型である古典的Zellweger症候群の患者は、生後1年以内に死亡することが多く、その背景には重度の多臓器機能不全が関与しています。
ZSDは重症型から軽症型まで幅広い臨床像を持つ疾患群であり、過去に個別の疾患として定義されていたZWS、NALD、IRDは、現在ではZSDという包括的な名称の下で統一されています。重症型の患者は出生直後に診断されることが多く、筋緊張低下や授乳困難、脳の発達異常、新生児けいれん、腎嚢胞、膝蓋骨や長骨の点状軟骨異形成、さらには重度の肝臓病が特徴的です。こうした患者の多くは発達の進展を見せることなく、1年以内に死亡します。

一方、中間型や軽症型の患者では、症状の進行が緩やかであり、感覚障害(網膜ジストロフィーや感音性難聴)、神経学的異常(運動失調、多発ニューロパチー、白質ジストロフィー)、肝臓病、副腎不全、腎臓結石などが徐々に現れます。筋緊張低下や発達遅滞は一般的な症状ですが、知的発達が正常な場合もあります。また、軽症型では骨密度の減少や歯のエナメル形成不全(特に第二大臼歯)がしばしば認められます。
ZSDの診断は、これらの臨床症状や特徴的な生化学的異常の確認に加え、13のZSD-PEX遺伝子の病的変異を同定することで確定されます。治療は主に対症療法が中心であり、患者の栄養状態を改善するための胃ろうや、感覚障害に対処するための補助具(聴覚補助具や視覚補正具)、発作のコントロールのための抗けいれん薬、脂溶性ビタミンやコール酸の補充が行われます。また、発達支援、副腎機能不全の治療、さらには骨密度低下や歯科的問題への対応も重要です。

ZSDは主に劣性遺伝形式で遺伝し、患者の兄弟姉妹は25%の確率で発症、50%の確率で保因者、25%の確率で健康で非保因者となる可能性があります。病的変異が特定されている場合には、出生前診断や家族内での保因者検査が可能です。
地域による発症率の違いも顕著で、日本では出生50万件あたり約1件の頻度で報告されています。これは、欧州で一般的なPEX1遺伝子の特定の変異が日本では稀であることが一因とされています。こうした背景から、ZSDをより深く理解し、新たな治療法を開発するためには、さらなる研究と患者・家族への包括的な支援が求められています。
[2_PLAGL1][3_HYMAI] 糖尿病、6q24関連一過性新生児(6q24-Related Transient Neonatal Diabetes Mellitus)



6q24関連一過性新生児糖尿病(6q24-TNDM)は、新生児期に発症する非常に稀な糖尿病で、主に6q24領域に存在するインプリンティング遺伝子である「PLAGL1」と「HYMAI」の異常が原因とされています。インプリンティング遺伝子とは、両親どちらか一方から遺伝子が受け継がれても、特定の親由来の遺伝子だけが活性化され、もう一方は不活性化されるという特殊な制御を受ける遺伝子を指します。この疾患では、この制御が異常をきたし、結果として糖尿病の症状が現れます。
6q24-TNDMは出生直後に高血糖を引き起こし、新生児期早期、つまり生後1か月以内に診断されることが一般的です。この糖尿病は多くの場合、生後3か月を目安に自然寛解しますが、一部の患者では永続的な糖尿病へと移行することもあります。また、寛解した場合でも思春期や成人期、さらには妊娠中に糖尿病が再発するケースも報告されています。以下では、この疾患を引き起こす遺伝的要因や、臨床症状、診断方法、治療の流れについて詳しく解説します。

PLAGL1遺伝子は、亜鉛指型タンパク質(Zinc Finger Protein)をコードしており、細胞内で転写活性化因子として働きます。具体的には、ホルモン調節に関わる下垂体アデニル酸シクラーゼ活性化ポリペプチド(PACAP)の受容体の転写を制御するなど、発生や代謝において重要な役割を担っています。この遺伝子の異常、特にプロモーター領域の低メチル化(遺伝子発現の抑制が緩む現象)が、父親由来のアレルの過剰発現を引き起こし、一過性新生児糖尿病(TNDM)の主な原因となります。さらに、ZFP57という遺伝子の変異も、この低メチル化を誘発する要因として関連しています。
一方、HYMAI遺伝子は、タンパク質をコードしないRNA(非翻訳RNA)を生成する遺伝子です。この遺伝子もインプリンティングされており、父親由来のアレルからのみ発現します。HYMAIとPLAGL1は非常に近い位置関係にあり、共に6q24領域に存在します。この2つの遺伝子が異常に発現することで、糖尿病発症のメカニズムが形成されると考えられています。

6q24-TNDMは以下の3つの主な遺伝的異常によって引き起こされます:(1) 父親由来の6番染色体が2本存在する片親性ダイソミー(UPD6)、(2) 父親由来の6q24領域の重複、(3) 母親由来PLAGL1プロモーター領域の低メチル化です。これらの異常は、PLAGL1およびHYMAIの通常量を超える過剰な発現をもたらします。特に、低メチル化が広範囲に及ぶ多領域インプリンティング異常(MLID)が伴う場合、糖尿病だけでなく筋緊張低下、心疾患、てんかん、腎奇形などの多彩な症状が現れることがあります。
6q24-TNDMの臨床症状には、出生時の著しい胎内発育遅延、脱水、体重増加不良、そして新生児期早期の高血糖が挙げられます。これらの症状は通常、インスリン分泌の異常が原因で起こります。高血糖が続くと、体内の水分が失われ脱水状態に陥るため、診断時にはインスリン治療や補液が必要となります。一過性の場合、多くの患者は生後3か月以内に寛解しますが、再発する可能性を考慮し、注意深い経過観察が求められます。
診断には、DNAメチル化解析が重要な役割を果たします。この解析により、6q24領域における低メチル化が確認されます。追加の遺伝子検査を行うことで、遺伝的異常の具体的なメカニズムを明らかにし、患者および家族への遺伝カウンセリングが可能になります。これにより、再発リスクや家族内遺伝の可能性について適切な情報提供が行えます。

治療は、初期には脱水や高血糖の管理が最優先です。急性期には補液とインスリン治療を組み合わせて症状を改善し、その後、血糖値の安定化に応じて治療方針が調整されます。一旦寛解した後も、特に感染症やストレスが糖尿病再発の引き金になることがあるため、保護者や医療者は再発の兆候に注意を払う必要があります。再発時の治療には、食事療法や経口薬、場合によってはインスリン注射が用いられます。
このように、6q24-TNDMは遺伝的背景とインプリンティング異常が密接に関連する疾患であり、その管理には正確な診断と適切な治療が不可欠です。また、遺伝カウンセリングや定期的な経過観察を通じて、患者や家族の負担を軽減し、長期的な健康を維持することが重要です。
[4_STX11] 家族性血球貪食性リンパ組織球症(Familial Hemophagocytic Lymphohistiocytosis)


家族性血球貪食性リンパ組織球症4型(Familial Hemophagocytic Lymphohistiocytosis Type 4, FHL4)は、非常に稀な遺伝性疾患であり、STX11遺伝子の変異によって引き起こされます。この疾患では、免疫系の制御機能が異常をきたし、体内で過剰な炎症反応が起こります。その結果、サイトカインと呼ばれる炎症性タンパク質が過剰に産生される「ハイパーサイトカイネミア」が発生し、さらに自然免疫を担うナチュラルキラー細胞の機能が著しく低下します。また、活性化したリンパ球やマクロファージが骨髄、肝臓、脾臓、さらには中枢神経系を含むさまざまな臓器に浸潤し、深刻な臓器障害を引き起こします。

STX11遺伝子は、シンタキシン11(Syntaxin-11)と呼ばれるSNAREタンパク質をコードしています。このタンパク質は、後期エンドソームとトランスゴルジ網(trans-Golgi network)の間でタンパク質輸送を調節する重要な役割を担っています。この遺伝子に機能喪失を引き起こす変異が生じると、細胞内の物質輸送が正常に行われなくなり、FHL4の病態形成に繋がります。
FHL4の主な臨床的特徴としては、持続的で高い発熱、肝臓と脾臓が大きく腫れる肝脾腫(hepatosplenomegaly)、血球減少(cytopenia)が挙げられます。また、神経系にも影響が及ぶことがあり、刺激に対する過敏反応や筋緊張の低下(hypotonia)から、けいれん、脳神経障害、運動失調(ataxia)など多岐にわたる症状がみられる場合があります。これらの症状は、免疫系が異常に活性化し、全身の臓器を侵襲することで引き起こされます。

家族性血球貪食性リンパ組織球症(fHLH)は、PRF1、STX11、STXBP2、UNC13Dといった遺伝子に両アレルの病原性変異が存在する場合に診断されます。この疾患は一般的に急性発症であり、数週間以上続く高熱、肝脾腫、血球減少といった特徴を持ちます。発疹やリンパ節腫脹はまれですが、肝機能障害や神経学的症状が進行すると、さらに深刻な臓器障害が発生することがあります。発症は通常、生後数ヶ月から数年以内に見られますが、稀に成人で発症するケースも報告されています。
治療が行われない場合、特に乳児では発症後2ヶ月以内に致命的となることが多いです。その主な死因としては、疾患の進行、臓器不全、侵襲性感染症、出血などが挙げられます。しかし、化学免疫療法(HLH-94やHLH-2004プロトコル)とその後の同種造血幹細胞移植(HSCT)の導入により、生存率は大幅に向上しました。

FHL4の診断は、臨床症状の観察に加え、STX11遺伝子の変異を特定するための遺伝子検査によって確定されます。この遺伝子変異は、特に中東地域に多く見られるとされていますが、他の地域や民族でも報告例があります。
治療の主軸となるのは、エトポシド(etoposide)を含む化学免疫療法と同種造血幹細胞移植です。また、近年ではインターフェロンγ抗体(emapalumab)を用いた新しい治療法も登場しており、治療選択肢が拡大しています。これらの治療に加え、感染症予防や対症療法として抗菌薬や抗ウイルス薬、解熱剤、輸液、血液製剤の投与などの支持療法が重要です。
予後管理としては、治療中および治療後の合併症リスクを注意深く監視する必要があります。特に、出血、呼吸障害、神経学的な合併症、感染症、肝機能障害などを早期に発見し、適切な対応を行うことが求められます。また、免疫抑制中の患者には、生ワクチンの接種や感染症への曝露を避けることが強く推奨されます。

FHL4の遺伝形式は常染色体劣性遺伝であり、両親が保因者である場合、生まれてくる子どもが病原性変異を両方受け継ぐ確率は25%です。遺伝子検査を通じて保因者を早期に特定し、必要に応じてHSCTを計画することで、発症を未然に防ぐ可能性があります。
FHL4は複雑で深刻な疾患ですが、早期診断と適切な治療が患者の予後を大きく改善する鍵となります。この疾患に関する研究や治療法の進展により、患者の生存率と生活の質は今後さらに向上することが期待されています。
[5_EPM2A] (Progressive Myoclonus Epilepsy, Lafora Type)


ラフォラ型ミオクローヌスてんかん(MELF1)は、進行性ミオクローヌスてんかんの一種で、非常に稀な遺伝性疾患です。この疾患は、EPM2A遺伝子の変異が原因で発症します。EPM2A遺伝子は6q24.3というゲノム領域に位置し、ラフォリンという重要なタンパク質をコードしています。このラフォリンは、体内でグリコーゲンの正常な代謝を維持するために欠かせない役割を果たしています。具体的には、グリコーゲンが過剰にリン酸化されることを防ぎ、不溶性の凝集体が形成されるのを抑制します。この機能を持つラフォリンは、グリコーゲンホスファターゼとして働くほか、グリコーゲン代謝に関与するタンパク質を分解するための仕組みであるユビキチン化を促進します。特に、E3ユビキチンリガーゼであるNHLRC1(別名マリン)との相互作用を通じて、細胞内で不要となったタンパク質を効率的に分解します。このようなラフォリンの機能が失われると、グリコーゲンが異常に蓄積し、不溶性のデンプン様物質であるラフォラ小体(Lafora bodies, LBs)が形成されることにより、ラフォラ病の症状が進行します。

この疾患は常染色体劣性遺伝の形式を取り、両親がそれぞれEPM2AまたはNHLRC1遺伝子の変異を保因している場合、子どもがこの病気を発症する確率は25%です。発症は通常、8歳から18歳の間に見られますが、多くの場合、思春期の間に発症します。初期症状には、頭痛やミオクローヌス(筋肉が短時間けいれんする症状)、全般性けいれん、そして視覚的幻覚(光や模様が見えるなど)が含まれます。病気が進行すると、てんかん発作が頻発し、認知機能が徐々に低下して最終的には認知症に至ります。発症から10年以内に、ほとんどの患者が亡くなるという重篤な経過をたどります。
ラフォラ病の進行性の特徴は、特に後頭葉発作の頻発に現れます。これにより、一時的に視覚が失われたり、視覚的幻覚を経験することがしばしばあります。また、全般性強直間代発作、意識障害を伴う部分発作、そして脱力発作なども観察されています。これらの発作は時間の経過とともに制御が難しくなり、けいれんが止まらない状態である「重積状態」に陥ることが多いです。認知機能の低下は発作の発症とほぼ同時期に始まり、構音障害(言葉が不明瞭になる症状)や運動失調(歩行や動作がぎこちなくなる症状)も早い段階で現れます。感情面でも不安定さが見られ、進行すると完全に歩行能力を失い、最終的には植物状態に至るケースが多いです。

診断は、典型的な神経学的症状を基に行われますが、最も確実な方法は遺伝子検査で、EPM2AまたはNHLRC1遺伝子の病的変異を確認することです。また、ラフォラ小体を確認するために皮膚生検が必要になることもあります。しかしながら、現在の医学では根本的な治療法は存在しておらず、治療の目的は症状を緩和し患者の生活の質を向上させることにあります。抗てんかん薬(例:valproic acidやbenzodiazepines)は発作を一時的に抑える効果がありますが、疾患の進行を止めることはできません。進行期には、嚥下障害や誤嚥性肺炎を予防するため、胃瘻の導入が検討されることがあります。また、理学療法や心理的サポートも重要で、患者とその家族を支えるための包括的なケアが求められます。
ラフォラ病は非常に稀な疾患で、全世界の有病率は約100万人に4人と推定されています。この病気の発症頻度は地域や民族によって異なり、地中海沿岸、インド、中東などの地域では比較的多く見られる一方、フィンランドのように報告例がない地域も存在します。このような地域差は、近親婚の頻度や特定の遺伝的要因が関与している可能性があります。
ラフォラ病に関する研究は進行中であり、将来的には根本的な治療法の開発が期待されていますが、現時点では支持療法が中心です。この病気の管理には、神経内科医、遺伝カウンセラー、理学療法士、心理学者など、複数分野の専門家が連携することが不可欠です。これにより、患者の生活の質をできる限り維持し、合併症を予防することが目指されています。
[6_GRM1] 自律劣性小脳失調症13型(Hereditary Ataxia(SCAR13))


「自律劣性小脳失調症13型(SCAR13)」は、非常にまれな神経疾患であり、小脳の機能や発達に深く関わる遺伝子GRM1の異常によって引き起こされます。この遺伝子は、代謝型グルタミン酸受容体1(Metabotropic Glutamate Receptor 1、mGluR1)をコードしており、小脳のプルキンエ細胞に多く存在します。この受容体は、神経伝達物質であるグルタミン酸と結合することで神経細胞内に信号を送り、シナプスの働きを調整します。特に、小脳での学習や運動の調整に重要な「長期シナプス可塑性」の維持に関わります。この機能が失われると、小脳の発達や運動制御が障害され、SCAR13のような病態が発生します。
SCAR13の発症は、通常、乳幼児期に見られます。この病気の主な特徴は、運動や精神の発達の遅れです。患者は軽度から重度の知的障害を伴うことが多く、言語能力が著しく低下するか、全く発達しないことがあります。また、姿勢や歩行の調整が難しい失調(アタキシア)、筋力の低下、反射が過剰に強くなるハイパーリフレクシア、そして眼球の異常な動き(眼振など)もよく見られる症状です。さらに、癲癇や末梢神経障害(ポリニューロパチー)を伴うケースもあります。画像診断では、小脳の萎縮や脳室の拡大が確認されることが一般的です。

ある典型的な症例では、8歳の患者が歩行の自立ができず、言語発達も見られないという重度の症状を示しました。この患者では全身の筋緊張が低下し、軽度の眼振や嚥下障害も確認されました。遺伝子解析の結果、GRM1遺伝子において病的な二重変異(複合ヘテロ接合変異)が見つかり、これがSCAR13の原因であると診断されました。
SCAR13は進行性の小脳疾患であり、根本的な治療法はまだ存在しません。そのため、患者とその家族には早期診断と包括的な支援が非常に重要です。治療の目的は、症状の進行を抑えながら生活の質を最大限に向上させることです。具体的には、多職種によるチーム支援が推奨されており、神経科医、理学療法士、作業療法士、リハビリテーション医、栄養士、言語療法士などが関わります。
たとえば、運動機能の低下には、バランス訓練や歩行訓練、筋力トレーニングが有効です。患者の状態に応じて、杖や歩行器などの補助具を利用することで、日常生活の自立を支援します。また、誤嚥を防ぐためには、食事の形態を調整したり、栄養管理を徹底したりすることが求められます。さらに、言語療法士が患者のコミュニケーション手段を工夫し、デジタルデバイスの利用を提案する場合もあります。

一部の症状に対しては薬物療法が効果を発揮することもあります。たとえば、筋肉の緊張を和らげるためにバクロフェンやチザニジンが使用され、精神的な症状(抑うつや不安など)には標準的な精神科治療が行われます。また、家庭環境を調整することで転倒などのリスクを減らし、患者の安全を確保することも重要です。
SCAR13は非常に希少な疾患であるため、専門的な医療支援や福祉制度の活用が必要不可欠です。それぞれの患者に合わせた個別のケアを提供することで、日常生活の質を向上させることが可能です。このように、医学的な支援と家族の協力が一体となることで、患者ができる限り充実した生活を送れるようにすることが目指されています。
[7_SYNE1] SYNE1欠損症(SYNE1 Deficiency)


SYNE1欠損症は、染色体6q25.2に位置するSYNE1遺伝子の変異によって引き起こされる遺伝性疾患です。この遺伝子は、ネスプリン1(Nesprin-1)というタンパク質をコードしています。ネスプリン1は細胞の構造を支える役割を果たし、特に細胞核を細胞骨格に接続することで、細胞の機能と安定性を保つ重要な役割を担っています。SYNE1遺伝子の機能が失われると、細胞内の構造的安定性が損なわれ、以下のような3つの疾患につながる可能性があります。
1つ目は「常染色体劣性遺伝性脊髄小脳失調症8型(SCAR8)」です。これは小脳に関連する疾患で、歩行の協調性が失われる、手の動きがぎこちなくなる、話し方が不明瞭になるといった症状が徐々に進行します。これらの症状は小脳の退行変性が原因で、場合によっては脳幹や脊髄の機能にも影響を及ぼすことがあります。
2つ目は「エメリードレイファス型筋ジストロフィー4型(EDMD4)」で、筋力低下や筋肉の萎縮を特徴とする進行性疾患です。この疾患では、早期に肘やアキレス腱、脊柱の関節が拘縮し、心筋症や心臓伝導異常が発生します。
3つ目は「先天性多発性関節拘縮症3型(AMC3)」です。この疾患は、胎児期の運動が低下することによって引き起こされるもので、関節の拘縮、筋力低下、運動発達の遅れ、歩行能力の喪失といった症状が見られます。また、骨格の異常や指の関節の拘縮が長期間持続するケースもあります。

SYNE1欠損症の症状は非常に多様で、軽度の常染色体劣性小脳失調症から重度のAMCに至るまでの広い表現型スペクトラムを持っています。特に成人期(6~45歳)に発症するSYNE1欠損型小脳失調症は、この疾患群の中でも最も一般的に認識されています。このタイプでは、緩やかに進行する小脳失調、構音障害、眼球運動の異常がみられますが、上位運動ニューロン(痙性、反射亢進、バビンスキー反射など)や下位運動ニューロン(筋萎縮、反射低下、筋線維束攣縮など)の障害を伴うことが多いです。さらに、注意力や実行機能、視覚空間認知能力に深刻な障害を示すケースも報告されています。
一方、小児期発症型では、多系統にわたる深刻な影響が見られます。小脳失調や運動ニューロンの障害に加え、筋力低下や筋萎縮、知的障害、思春期以降の呼吸不全などが症状に含まれます。新生児期発症型では、「フロッピーインファント」として出生し、胎児期の運動低下や重度の筋低緊張、多発性関節拘縮を特徴とします。

SYNE1欠損症の診断は、臨床的な症状を基にし、SYNE1遺伝子の変異を遺伝学的検査で特定することで確定されます。しかし、現時点でこの疾患を直接治療する方法はなく、主に症状の管理と合併症の予防を目的としたケアが行われます。これには、神経内科医、作業療法士、理学療法士、整形外科医、栄養士、言語療法士、呼吸療法士、心理士など、多職種チームによる包括的な支援が必要です。
SYNE1欠損症は常染色体劣性遺伝形式で遺伝します。つまり、患者の両親はそれぞれ1つの変異を持つ無症状キャリアである可能性が高いです。この場合、患者のきょうだいが疾患を発症する確率は25%、無症状キャリアである確率は50%、変異を持たない確率は25%です。家族内のキャリア診断や出生前診断も可能であり、必要に応じて行われることがあります。

この疾患は、もともとフランス系カナダ人集団で最初に報告されましたが、現在では日本、ヨーロッパ、中東、ブラジルなど世界各地で確認されています。特にフランス系カナダ人集団では、同じ遺伝的背景を持つ人が多いため、発症率が高いとされています。
治療法が確立されていない現状では、患者の生活の質を維持し、できるだけ合併症を予防するためのリハビリテーションや適応支援が重要です。
[8_ARID1B] ARID1B関連疾患;先天性横隔膜ヘルニア:コフィン・シリス症候群(ARID1B-Related Disorder; Congenital Diaphragmatic Hernia; Coffin-Siris Syndrome)


ARID1B関連疾患(ARID1B-Related Disorder, ARID1B-RD)は、ARID1B遺伝子に異常が生じることで発症する疾患で、臨床的な症状には幅広いスペクトラムが見られます。この疾患は、典型的なコフィン・シリス症候群1(Coffin-Siris Syndrome 1, CSS1)を含む一連の症状として特徴づけられます。ARID1B遺伝子は染色体6q25.3領域に位置し、転写の活性化および抑制に関与するタンパク質「AT-rich interactive domain-containing protein 1B」をコードしています。このタンパク質は、クロマチンリモデリング(DNAとヒストンの構造をATP依存的に変化させるプロセス)を介して遺伝子発現を調節し、特に神経細胞の発達において重要な役割を果たしています。
クロマチンリモデリングは、細胞内のDNAがヒストンと呼ばれるタンパク質に巻き付いて構造を形成するクロマチンを、酵素的に再構築するプロセスです。このプロセスによって、特定の遺伝子が転写可能な状態になり、細胞の成長や分化が適切に進行します。ARID1Bタンパク質は、SWI/SNFと呼ばれるクロマチンリモデリング複合体の主要構成要素であり、幹細胞が神経細胞へと分化する際に不可欠な役割を担っています。この過程が適切に行われない場合、ARID1B関連疾患が発症し、さまざまな症状が現れると考えられています。

ARID1B関連疾患の中心的な特徴の一つは、コフィン・シリス症候群として知られる症状群です。この症候群では、手足の第5指(小指)の爪や末節骨が欠損または未発達になるほか、発達遅滞や知的障害が見られます。また、特徴的な顔貌(広い鼻梁や厚い唇)、筋緊張低下、過剰な体毛(特に背中や顔)といった身体的特徴が現れることがあります。これらに加え、心臓、消化器、泌尿器、中枢神経系に奇形が生じる場合もあり、摂食困難や低身長、眼科的異常(近視や斜視)、難聴、てんかんなどの症状も頻繁に報告されています。さらに、注意欠如・多動症(ADHD)や自閉症スペクトラム症状が見られる場合もあります。これらの症状は、疾患の重症度や個々の患者によって異なり、多様性があります。
この疾患の診断は、まず患者の臨床的特徴を観察し、次に分子遺伝学的検査によってARID1B遺伝子の病原性変異を特定することで確定します。多くのケースでは、新生変異(de novo mutation)と呼ばれる、生まれつき親から受け継がれていない突然変異が原因とされていますが、一部では家族性の遺伝も報告されています。この疾患は常染色体優性遺伝形式をとるため、親のどちらかが病原性変異を持っている場合、子供に遺伝する可能性があります。

治療の主な目的は、症状を管理し患者の生活の質を向上させることです。例えば、眼科や耳鼻科での視覚や聴覚の補正、先天性心疾患や消化管逆流症の治療、摂食困難への対応(必要に応じて経鼻胃管や胃瘻を利用)などが含まれます。また、発達遅滞に対しては、言語療法、作業療法、理学療法が推奨されます。行動面での問題や多動、自閉症スペクトラム症状に対しては、行動療法や必要に応じた薬物療法が効果的です。さらに、てんかん発作を伴う患者には、標準的な抗てんかん薬が使用されます。
予後に関しては、データが限られているものの、50歳以上まで生存した例も報告されています。このことから、成人までの生存は可能であり、適切な支援と長期的な経過観察が重要です。ただし、症状には個人差が大きいため、それぞれの患者に応じた柔軟な対応が求められます。

ARID1B関連疾患の発生頻度はおよそ1万人から10万人に1人と推定されています。この疾患を早期に発見し、適切な治療と支援を提供するためには、遺伝カウンセリングや診断技術の普及が不可欠です。今後、さらなる研究や啓発活動が求められており、患者やその家族がより良い生活を送れるよう、社会全体で支える仕組みを構築することが重要です。
[9_SERAC1] 難聴、脳症、リー様症候群を伴う 3-メチルグルタコン酸尿症(3-methylglutaconic aciduria with deafness, encephalopathy, and Leigh-like syndrome (MEGDEL))


3-メチルグルタコン酸尿症を伴う難聴、脳症、リー様症候群(MEGDEL)は、非常に稀な遺伝性疾患であり、6q25.3染色体領域に位置するSERAC1遺伝子の変異によって引き起こされます。この疾患は常染色体劣性遺伝形式で遺伝し、両親からそれぞれ受け継いだ病的な遺伝子が原因で発症します。SERAC1遺伝子は、タンパク質SERAC1をコードしており、このタンパク質は、ミトコンドリアの機能や細胞内コレステロールの輸送に不可欠なホスファチジルグリセロールのリモデリングを担っています。さらに、SERAC1はホスファチジルグリセロール-36:1の生成に関与する酵素反応や、ビス(モノアシルグリセロール)リン酸(BMP)の生合成経路にも関連していると考えられています。このような役割を担うSERAC1が正常に機能しないと、ミトコンドリア機能や細胞内の脂質輸送が深刻に影響を受けます。
この遺伝子の機能喪失によって発症するMEGDEL症候群は、乳幼児期に現れる疾患で、主に精神運動発達の遅れや退行、感音性難聴、痙縮(筋肉が常に硬直した状態)やジストニア(異常な筋緊張による体の動きの異常)を特徴とします。これに加えて、尿中の3-メチルグルタコン酸という特定の有機酸が通常より高濃度で排泄されることが確認されます。脳の画像検査では、大脳および小脳の萎縮が認められ、リー症候群に見られるような基底核の病変が特徴的です。また、血液検査では乳酸やアラニン濃度の増加が見られるほか、線維芽細胞内でのホスファチジルグリセロールとカルジオリピンの異常、さらに細胞内の未エステル化コレステロールの蓄積が確認されます。これらは、SERAC1の機能が正常に働かない結果として起こる現象です。

症状は多岐にわたり、患者の年齢によって異なる進行を示します。新生児期には低血糖や感染症に類似した症状が見られますが、感染源は特定されません。乳児期には摂食困難、体重増加不良、体幹の筋緊張低下が顕著となり、一部の乳児では肝障害が一時的に生じます。肝障害の範囲は軽度なトランスアミナーゼの変動から重篤な肝不全までさまざまです。2歳頃までに、難聴、ジストニア、痙縮が進行し、発達した運動能力や認知能力が失われることが多いです。この段階になると、患者は日常生活全般で介助が必要となり、言葉の発達もほとんど見られません。
診断は、臨床症状や尿中での3-メチルグルタコン酸の排泄量増加といった代謝的所見に基づき、分子遺伝学的検査でSERAC1遺伝子の病的変異が確認されることで確定されます。

治療は対症療法が中心で、複数の専門家からなるチームによる総合的なケアが推奨されます。例えば、経口または髄腔内バクロフェンが一部の患者で痙縮を一時的に改善することがあります。また、過剰な唾液分泌が呼吸に影響を与える場合には、唾液腺へのボツリヌス毒素注射や唾液腺管の手術的処置が考慮されます。さらに、食事療法は経鼻胃管や胃瘻を通じて行われ、これによって栄養状態の改善や全体的な症状の軽減が期待されます。
MEGDEL症候群の患者は、幼児期の重症型から成人期に見られる軽症型まで、幅広い症状を示します。この疾患は極めて稀で、推定される有病率は10万人に0.09人とされています。症状が脳性麻痺に似ているため、特にMRIでの異常が確認されない場合、誤診されることもあります。そのため、非典型的な脳性麻痺が疑われる場合には、尿中有機酸分析を行うことが推奨されます。
また、MEGDEL症候群を持つ患者の発達支援には、適切な早期介入や教育支援が重要です。これには、言語療法や理学療法などの専門的リハビリテーションの提供が含まれます。個々の患者のニーズに応じたケアを行うことで、生活の質を最大限に向上させることが目指されています。
[10_RSPH3] 原発性繊毛運動障害 32(Primary Ciliary Dyskinesia 32 (CILD32))


原発性線毛機能不全32型(Ciliary Dyskinesia, Primary, 32、略称CILD32)は、6q25.3という染色体上のRSPH3遺伝子の変異によって引き起こされる、極めて稀な遺伝性疾患です。この遺伝子は「ラジアルスポークヘッドタンパク質3(Radial Spoke Head Protein 3 Homolog)」をコードしており、このタンパク質は、線毛や精子の運動において重要な役割を担っています。具体的には、線毛運動のための「軸索内ラジアルスポーク複合体」の構成要素であり、さらにcAMP依存性タンパク質キナーゼ(PKA)を固定する足場タンパク質としても機能します。このタンパク質は、線毛内でMAPKやPKAといったシグナル伝達経路の交差点として働く可能性も示唆されています。この遺伝子の機能喪失は、線毛の構造的異常や機能不全を引き起こし、CILD32の発症に至ります。

CILD32は、線毛運動に深刻な障害をもたらす疾患です。線毛は、体内の多くの器官で重要な役割を果たしており、呼吸器官の粘液や異物の排除、精子の運動、さらには女性の卵管内での卵子の移動などに関与しています。この疾患では線毛が適切に機能しないため、特に呼吸器や生殖器にさまざまな問題が現れます。
主な症状として、呼吸器の慢性炎症や気管支拡張症が挙げられます。新生児期から呼吸障害を示すことが多く、これを「新生児呼吸窮迫症候群」と呼びます。鼻腔や気管内に蓄積する粘液を適切に除去できないため、慢性的な感染症が続き、これが肺の機能を徐々に損なう原因となります。特に成人では、気管支拡張症がほぼすべての患者で確認され、胸部CT検査で明らかになります。また、慢性の咳や痰の産生、繰り返される呼吸器感染症が見られるのも特徴です。
生殖機能にも影響が及びます。男性のほとんどは精子運動の異常により不妊症となり、女性の場合は卵管内の線毛機能障害によって受胎能力が低下し、さらに子宮外妊娠のリスクも高まります。

CILD32では、線毛運動を担う「9+2構造」(線毛内の特有の微細構造)に異常が見られますが、この疾患に関連する内臓の左右配置異常(シトゥス異常)は報告されていません。遺伝形式は常染色体劣性遺伝で、両親がそれぞれ変異遺伝子を保持している場合に子供が発症する可能性があります。
診断には、臨床症状の確認や遺伝子検査が重要です。例えば、鼻腔一酸化窒素濃度の測定や線毛の超微細構造の解析が診断の助けとなります。さらに、特定の遺伝子変異を確認することで診断が確定しますが、一部の患者では関連する遺伝子変異が検出されない場合もあるため、多角的な検査が必要です。

治療法としては、症状の管理と合併症の予防が中心となります。具体的には、呼吸器の粘液除去を促進するための胸部理学療法(例:胸部の叩打や体位ドレナージ)や、感染予防のためのワクチン接種、抗生物質の使用などが挙げられます。中耳炎が重症化する場合には鼓膜チューブの挿入が有効な場合もあります。また、聴覚障害が進行した場合には補聴器や言語療法が必要になることもあります。
予防的な措置としては、感染症対策が非常に重要です。手洗いや感染者との接触を避けること、そして喫煙や大気汚染の回避が推奨されます。また、症状の進行を遅らせるために定期的な検査やモニタリングを行うことが重要です。
CILD32は極めて稀な疾患であり、その原因となるRSPH3遺伝子の変異も非常に稀ですが、早期の診断と適切な管理は患者の生活の質を大きく向上させる鍵となります。この疾患についての理解を深めることは、今後の治療法の開発や患者支援の改善につながると期待されています。
引用文献
- Zariwala MA, Knowles MR, Leigh MW. Primary Ciliary Dyskinesia. 2007 Jan 24 [Updated 2019 Dec 5]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1122/
- Wortmann SB, de Brouwer APM, Wevers RA, et al. SERAC1 Deficiency. 2014 Apr 17 [Updated 2020 Jul 23]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK195853/
- Vergano SA, van der Sluijs PJ, Santen G. ARID1B-Related Disorder. 2019 May 23. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK541502/
- Beaudin M, Gamache PL, Gros-Louis F, et al. SYNE1 Deficiency. 2007 Feb 23 [Updated 2018 Dec 6]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1379/
- Cesaroni, C. A., Pisanò, G., Trimarchi, G., Caraffi, S. G., Scandolo, G., Gnazzo, M., Frattini, D., Spagnoli, C., Rizzi, S., Dittadi, C., Sigona, G., Garavelli, L., & Fusco, C. (2024). Severe Neurodevelopmental Disorder in Autosomal Recessive Spinocerebellar Ataxia 13 (SCAR13) Caused by Two Novel Frameshift Variants in GRM1. Cerebellum (London, England), 23(5), 1768–1771. https://doi.org/10.1007/s12311-023-01617-2
- Perlman S. Hereditary Ataxia Overview. 1998 Oct 28 [Updated 2024 Sep 12]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1138/
- Minassian B. Progressive Myoclonus Epilepsy, Lafora Type. 2007 Dec 28 [Updated 2025 Jan 23]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1389/
- Zhang K, Astigarraga I, Bryceson Y, et al. Familial Hemophagocytic Lymphohistiocytosis. 2006 Mar 22 [Updated 2024 Jun 6]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1444/
- Temple IK, Mackay DJG. Diabetes Mellitus, 6q24-Related Transient Neonatal. 2005 Oct 10 [Updated 2018 Sep 13]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1534/
- Steinberg SJ, Raymond GV, Braverman NE, et al. Zellweger Spectrum Disorder. 2003 Dec 12 [Updated 2020 Oct 29]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1448/
- Perez, G., Barber, G. P., Benet-Pages, A., Casper, J., Clawson, H., Diekhans, M., Fischer, C., Gonzalez, J. N., Hinrichs, A. S., Lee, C. M., Nassar, L. R., Raney, B. J., Speir, M. L., van Baren, M. J., Vaske, C. J., Haussler, D., Kent, W. J., & Haeussler, M. (2024). The UCSC Genome Browser database: 2025 update. Nucleic Acids Research, gkae974. https://doi.org/10.1093/nar/gkae974
- Harrison, P. W., Amode, M. R., Austine-Orimoloye, O., Azov, A. G., Barba, M., Barnes, I., Becker, A., Bennett, R., Berry, A., Bhai, J., Bhurji, S. K., Boddu, S., Branco Lins, P. R., Brooks, L., Budhanuru Ramaraju, S., Campbell, L. I., Carbajo Martinez, M., Charkhchi, M., Chougule, K., … Yates, A. D. (2024). Ensembl 2024. Nucleic Acids Research, 52(D1), D891–D899. https://doi.org/10.1093/nar/gkad1049

 中文
中文