SOX5、SLCO1B1、KCNJ8、ABCC9、KRASの遺伝子変異は、ラム・シェーファー症候群、ローター症候群、カントゥー症候群、ブルガダ症候群、ヌーナン症候群などの希少疾患と関連しています。本記事では、それぞれの疾患の特徴、遺伝的背景、最新の研究情報について詳しく解説します。
この記事のまとめ
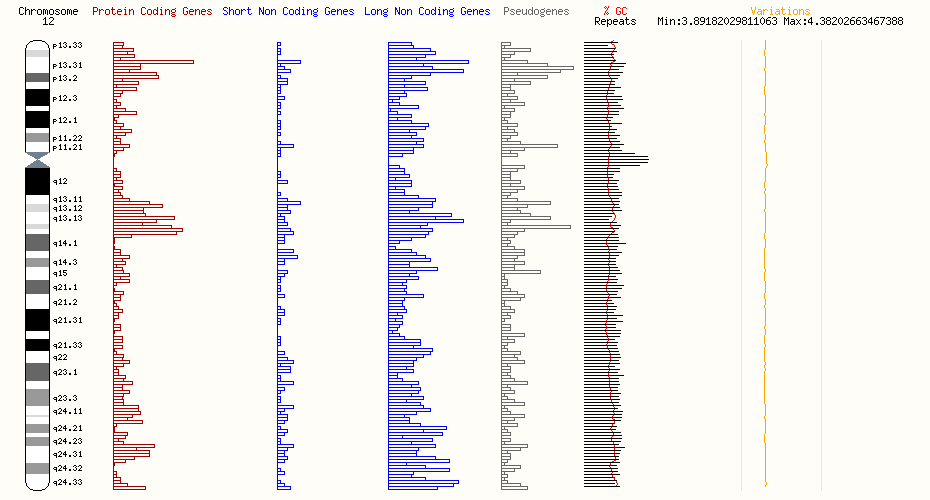
特定の遺伝子変異が希少疾患の発症にどのように関与するのかをご存じですか?本記事では、12p12.1にあるSOX5、SLCO1B1、KCNJ8、ABCC9、KRASの遺伝子と、それらが関与する疾患(ラム・シェーファー症候群、ローター症候群、カントゥー症候群、ブルガダ症候群、ヌーナン症候群)について解説します。最新の研究成果をもとに、それぞれの疾患の症状、診断方法、治療の可能性についても詳しく紹介します。
この遺伝子座にある疾患に関与する可能性が高い遺伝子

| S/N | 遺伝子名 | 関連疾患 | Associated disease description(s) |
| 1 | SOX5 | ラム・シェーファー症候群 | Lamb-Shaffer syndrome |
| 2 | SLCO1B1 | ローター症候群 | Rotor Syndrome |
| 3 | KCNJ8 | カントゥー症候群;ブルガダ症候群 | Cantú Syndrome; Brugada Syndrome |
| 4 | ABCC9 | カントゥー症候群;ブルガダ症候群 | Cantú Syndrome; Brugada Syndrome |
| 5 | KRAS | ヌーナン症候群 | Noonan Syndrome |
[1_SOX5] ラム・シェーファー症候群(Lamb-Shaffer syndrome)


Lamb-Shaffer症候群(ラム・シェーファー症候群、LSS)は、SOX5遺伝子の変異によって引き起こされる非常にまれな神経発達障害です。SOX5遺伝子は、脳の発達をはじめとする多くの生物学的プロセスに関与しており、この遺伝子に異常が生じると、発達の遅れ、知的障害、言語発達の遅れといった特徴が現れます。また、特有の顔の特徴を伴うことがあり、一部の患者では骨格の異常も報告されています。
LSSは、第12染色体の短腕(12p12.1)にあるSOX5遺伝子の変異によって発生します。SOX5は、細胞の成長や分化を調節する転写因子をコードしており、特に神経系や骨格の発達に重要な役割を果たします。LSSは「ハプロ不全」と呼ばれる状態が原因で発症します。これは、遺伝子の片方のコピーが正常に機能しないために、必要なタンパク質が十分に作られず、発達に影響を及ぼす現象です。SOX5はSOX遺伝子ファミリーに属しており、このファミリーに含まれる他の遺伝子も、さまざまな発達障害との関連が指摘されています。
LSSの主な特徴として、知的障害や言語発達の遅れが挙げられます。特に、表出(話す能力)の障害が顕著であり、重度の発話困難を伴うことが多いと報告されています。その他、多動や注意欠陥(ADHDのような症状)、自閉スペクトラム症に関連する特徴、視力の問題、さらには発作(けいれん)を伴うこともあります。顔の特徴としては、幅広い鼻梁(鼻の付け根)、くぼんだ目、広い口と厚い唇、小さなあごなどが挙げられます。また、一部の患者では低身長、側弯症(脊柱の湾曲)、関節の過可動性(関節が通常より柔らかい状態)も見られます。近年の研究では、痛みに鈍感な傾向や遠視(近くのものがぼやける視力障害)が、従来考えられていたよりもLSSの患者に多く見られる可能性があることが示唆されています。
2024年の時点で、世界で少なくとも113例のLSS患者が報告されています。しかし、この疾患は非常にまれであるため、診断されていないケースも多く、実際の患者数はこれよりも多い可能性があります。2020年に行われた研究では、41人の患者の遺伝子変異を分析した結果、SOX5の変異には主に3つのタイプがあることが確認されました。それは、欠失(遺伝子の一部が失われる)、切断型変異(タンパク質が途中で作られなくなる)、およびミスセンス変異(アミノ酸の置換が生じる)です。特に、多くのミスセンス変異は、SOX5の「HMG(ハイモビリティグループ)ドメイン」と呼ばれるDNA結合領域に影響を及ぼし、遺伝子の発現調節機能を損なうと考えられています。ただし、HMGドメイン外で発生した変異は、比較的軽度の症状を引き起こす傾向があるものの、遺伝子変異の種類と症状の重さとの間に明確な関連性は確認されていません。

SOX5は、人の発達に重要な役割を持つSOX遺伝子ファミリーの一員であり、性の決定、骨格形成、神経発達など、さまざまなプロセスに関与しています。例えば、SOX9遺伝子の変異は「キャンポメリック異形成」と呼ばれる骨の疾患を引き起こし、SOX18遺伝子の異常は「低毛症・リンパ浮腫・毛細血管拡張症症候群」と関連しています。動物実験では、SOX5が完全に欠失すると、重度の骨格異常や神経の発達異常が生じることが示されています。一方、遺伝子の片方のみが変異する場合(ヘテロ接合)では、影響が比較的軽減されることが確認されています。
LSSは「常染色体優性遺伝(顕性遺伝)」の形式で遺伝します。これは、SOX5遺伝子の片方に変異があるだけで疾患が発症することを意味します。しかし、現在報告されているほとんどの症例は「新生突然変異(de novo変異)」によるものであり、親から遺伝したものではなく、受精後に新たに発生した変異によるものと考えられています。この疾患は非常にまれであるため、診断が難しく、今後の研究によって、より詳細な症状の範囲や発症のメカニズム、治療法の可能性が明らかにされることが期待されています。

LSSの早期診断は、適切な治療やサポートを受けるために重要です。早期に診断されることで、専門的な教育支援や医療的なフォローアップを受けることができ、生活の質を向上させることが可能になります。また、遺伝カウンセリングを受けることで、家族が疾患について深く理解し、将来の妊娠におけるリスクを考慮する手助けとなります。現時点では、LSSに対する根本的な治療法は確立されていませんが、言語療法や作業療法などのサポート療法を受けることで、発達の遅れを軽減し、より良い生活を送ることができます。今後の研究や臨床試験を通じて、この疾患に対する理解が深まり、より効果的な治療や支援が提供されることが期待されています。
[2_SLCO1B1] ローター症候群(Rotor Syndrome)


ローター症候群は、体内でビリルビンを適切に処理する仕組みのバランスが崩れることで、軽度の黄疸を引き起こす稀な遺伝性疾患です。この疾患は、SLCO1B1遺伝子およびSLCO1B3遺伝子の変異によって発生します。これらの遺伝子は、12番染色体(12p12.1)上に存在し、それぞれOATP1B1およびOATP1B3という輸送タンパク質を作り出します。これらのタンパク質は、血液中のビリルビンや他の有機化合物を肝臓へ運ぶ役割を担っています。
通常、ビリルビンは赤血球が分解される際に生じる黄色い色素で、肝臓で処理され、胆汁として排泄されます。しかし、ローター症候群ではこれらの輸送タンパク質が欠損または機能不全を起こすため、ビリルビンが血液中に蓄積し、高ビリルビン血症(血液中のビリルビン濃度の上昇)を引き起こします。
この疾患の主な症状は、軽度で間欠的に現れる黄疸です。出生直後や幼少期に発症することが多く、皮膚や眼球の白目部分(結膜)が黄色く見えることがあります。ただし、肝機能そのものは正常で、肝障害や胆汁うっ滞(胆汁の流れの妨げ)は見られません。類似の疾患であるデュビン・ジョンソン症候群とは異なり、ローター症候群では肝臓に黒色の色素が蓄積することもありません。

ローター症候群は、常染色体劣性遺伝(両親からそれぞれ変異した遺伝子を受け継ぐことで発症する遺伝形式)によって引き起こされます。まれに、SLCO1B1およびSLCO1B3遺伝子の両方が大きく欠失することで発症する場合もあります。この疾患は非常にまれであり、血縁関係のある家族内で発症することが多いため、診断された場合には遺伝カウンセリングが推奨されることがあります。
診断は、主に「抱合型高ビリルビン血症(肝臓で処理されたビリルビンが血液中に増加する状態)」が単独で存在するかどうかを確認することで行われます。また、胆汁の流れを評価する「胆道シンチグラフィー」という画像検査によって、ローター症候群に特有のパターンを確認することが可能です。ただし、この検査が利用できない場合やリスクを伴う場合には、遺伝子検査による確定診断が可能です。
ローター症候群は健康に深刻な影響を及ぼす疾患ではないため、特別な治療は必要ありません。しかし、影響を受ける輸送タンパク質(OATP1B1およびOATP1B3)は、特定の薬剤を肝臓へ取り込む役割を持つため、薬の代謝に影響を与える可能性があります。例えば、コレステロールを下げるスタチン系薬剤、抗がん剤のメトトレキサート、高血圧治療薬のバルサルタンやエナラプリルなどは、これらの輸送タンパク質を介して肝臓に取り込まれます。ローター症候群の患者において、これらの薬剤による特別な副作用は報告されていませんが、薬の効果や毒性に影響を与える可能性があるため、服用時には慎重な管理が求められます。
ローター症候群は極めてまれな疾患であり、世界的な有病率は100万人に1人以下と推定されています。健康上の重大な問題を引き起こさないため、診断されずに経過する症例も少なくないと考えられます。

この疾患を他のビリルビン代謝異常と区別することは重要です。デュビン・ジョンソン症候群も同様に抱合型高ビリルビン血症を引き起こす良性の疾患ですが、ビリルビンの胆汁への分泌が妨げられる点が異なります。一方、ギルバート症候群やクリグラー・ナジャール症候群はビリルビンの抱合(肝臓で水に溶けやすい形に変える過程)に異常があり、非抱合型ビリルビンの上昇を引き起こします。ギルバート症候群は一般的で健康への影響はほとんどありませんが、クリグラー・ナジャール症候群I型は重篤な疾患で、適切な治療を行わなければ生命に関わる可能性があります。
ローター症候群の女性が妊娠しても、母体や胎児に特別なリスクをもたらすことはありません。ただし、高ビリルビン血症があるため、妊娠中に発症する肝疾患(例えば妊娠性肝内胆汁うっ滞など)の診断が難しくなる可能性があります。
ビリルビン代謝の仕組みを理解することは、高ビリルビン血症による影響を考えるうえで重要です。ビリルビンは赤血球の分解によって生じる副産物であり、高濃度になると毒性を持つことがあります。ローター症候群自体は健康に重大な影響を及ぼしませんが、新生児において非抱合型ビリルビンが過剰に蓄積すると、核黄疸(ビリルビンが脳に蓄積し、神経障害を引き起こす状態)を発症する可能性があります。薬剤によるアルブミンからのビリルビン遊離、血液脳関門の透過性の増加、長期間の高ビリルビン血症などが、この神経毒性に関与すると考えられています。新生児医療の進歩により、聴覚スクリーニングやMRI検査を活用したビリルビンによる脳障害の早期発見が可能になってきています。

まとめると、ローター症候群はビリルビン輸送の異常によって軽度の間欠的な黄疸を引き起こす稀な遺伝性疾患です。特別な治療は必要ありませんが、特定の薬剤の代謝に影響を与える可能性があるため注意が必要です。また、他のビリルビン代謝異常との鑑別診断が重要であり、遺伝カウンセリングが有益となる場合もあります。
[3_KCNJ8] カントゥー症候群;ブルガダ症候群(Cantú Syndrome; Brugada Syndrome)


KCNJ8遺伝子は、ヒトの第12染色体短腕(12p12.1)に位置し、ATP感受性内向き整流性カリウムチャネル8(ATP-sensitive inward rectifier potassium channel 8)というタンパク質をコードしています。このカリウムチャネルは細胞の電気的な活動を調整する重要な役割を担い、特に心臓においてその機能が重要視されています。Gタンパク質によって制御されるこのチャネルは、カリウムイオンを細胞内へ流入させる性質を持ち、細胞外のカリウム濃度によって活性が変化します。濃度が高くなると、チャネルの活性化がより正の電位へシフトする特徴があります。また、マグネシウムによる外向き電流の抑制や、バリウムによるチャネル活性の阻害といった影響も受けます。
KCNJ8遺伝子の変異は、ブルガダ症候群(Brugada Syndrome)やカントゥ症候群(Cantú Syndrome)といった重篤な疾患と関連しています。これらの疾患は、心臓を含む体内の電気信号の伝達異常によって引き起こされ、様々な症状や合併症を伴います。
ブルガダ症候群は、心臓の電気信号の異常を引き起こす疾患で、心電図(ECG)ではV1からV3の誘導に特徴的な異常が認められます。この疾患は致死性不整脈のリスクを高め、特に睡眠中に突然心停止を引き起こすことがあります。発症は主に成人期ですが、乳幼児を含むあらゆる年齢で症状が現れる可能性があります。東南アジアでは、これに類似した「睡眠中突然死症候群(Sudden Unexpected Nocturnal Death Syndrome, SUNDS)」が報告されており、ブルガダ症候群と多くの特徴を共有しています。
ブルガダ症候群は常染色体優性(autosomal dominant)遺伝形式をとるため、患者の子どもには50%の確率で変異が受け継がれます。ただし、発症の有無や症状の程度は個人差が大きく、「不完全浸透(reduced penetrance)」や「表現型の多様性(variable expressivity)」が見られます。多くの患者は親から変異を受け継いでいますが、新たな突然変異(de novo mutation)は比較的まれです。遺伝子検査によって家族内のリスクを特定でき、家族歴がある場合には出生前診断も可能です。

日本における疫学調査によると、ブルガダ症候群の心電図パターンの有病率は年齢によって異なります。成人を対象とした大規模研究では、約0.05%から0.6%の人にブルガダ症候群と一致する心電図異常が確認されています。一方、小児における有病率は低く、成人期以降の発症が多いと考えられています。
ブルガダ症候群の治療として最も効果的なのは、失神や心停止を経験した患者に対する植込み型除細動器(ICD: Implantable Cardioverter Defibrillator)の装着です。この装置は、致死性不整脈が発生した際に電気ショックを与えて正常な心拍に戻します。また、頻繁に危険な不整脈が発生する場合には、イソプロテレノール(isoproterenol)という薬剤が緊急処置として使用されます。不整脈を誘発する要因として、発熱、コカイン使用、電解質異常、特定の薬剤などがあり、これらを避けることも重要です。無症状の患者に対する治療方針は意見が分かれますが、家族歴や追加のリスク因子を考慮してICDの装着を勧める場合もあります。

カントゥ症候群は、極めてまれな遺伝性疾患で、多毛症(過剰な体毛)、特徴的な顔貌、心拡大や骨格異常を主な特徴とします。具体的には、広い鼻梁、大きな口と厚い唇、大舌症(macroglossia)などの特徴が見られます。出生時に診断されることが多く、生まれつき体毛が濃く、全身的に過剰な体毛が認められることがあります。また、新生児期には通常より大きな体格(巨児症: macrosomia)や浮腫(むくみ)が見られることがありますが、成長とともに改善する傾向があります。
カントゥ症候群における心臓の異常も重要な特徴の一つです。多くの患者では心拡大が見られ、心室の質量が増加しますが、心筋壁の厚さには異常がないことが多いです。心機能は通常正常ですが、一部の患者では運動耐性の低下がみられます。また、動脈管開存症(PDA: Patent Ductus Arteriosus)が高頻度で認められ、外科手術が必要になることがあります。さらに、心嚢液貯留(pericardial effusion)、大動脈の拡張、血管の蛇行(特に脳や眼の血管)といった異常も報告されています。肺高血圧症を発症する患者もおり、成長とともに改善する場合がある一方で、重症化することもあります。

カントゥ症候群の診断は、主にKCNJ8またはABCC9遺伝子の変異を特定する遺伝子検査によって確定されますが、これらの遺伝子に変異が見られない例もあり、他の遺伝的要因が関与している可能性があります。
治療は症状に応じて行われます。心疾患の管理が特に重要であり、心機能を監視するための定期的な心エコー検査や心電図が推奨されます。PDAに対しては外科的閉鎖が必要となることがあり、心嚢液貯留が進行した場合には排液処置が必要となることもあります。骨格異常に対しては装具の使用や手術、多毛症に対しては剃毛やレーザー治療などが行われることもあります。また、発達の遅れがある場合には、理学療法や言語療法による支援が推奨されます。

ブルガダ症候群とカントゥ症候群はいずれもJ波症候群(J-wave syndrome)と関連しており、心電図上に特有の異常波形が見られます。J波症候群は心臓の再分極異常を伴い、致死性不整脈のリスクを高める可能性があります。
これらの疾患に関する遺伝的理解が進むことで、今後、より正確な診断法や新たな治療法の開発が期待されています。現時点では、早期診断と適切な医学的管理が最善の対策とされています。
[4_ABCC9] カントゥー症候群;ブルガダ症候群(Cantú Syndrome; Brugada Syndrome)


ABCC9遺伝子は、ヒトの12番染色体の短腕(12p12.1)に位置し、ATP感受性カリウムチャネル(KATPチャネル)の構成要素となるタンパク質を作り出します。このKATPチャネルは、心臓や平滑筋をはじめとするさまざまな組織の電気的な活動を調節する役割を担っています。特に、ABCC9遺伝子はKCNJ11遺伝子と協力してKATPチャネルを形成します。KCNJ11がチャネルの通路部分を構成し、ABCC9はその活性化や調節に関与しています。
また、ABCC9遺伝子は心臓の機能に関与するだけでなく、個人の睡眠時間の違いにも関与している可能性が示唆されています。研究によると、この遺伝子のイントロン(タンパク質を作らない領域)に特定の変異があると、個人間の睡眠時間の差のおよそ5%が説明できるとされています。睡眠時間は遺伝的要因と環境要因の両方の影響を受けますが、全体として遺伝の影響は約40%と推定されており、ABCC9を含む複数の遺伝子が睡眠時間の調節に関与していると考えられています。
ABCC9遺伝子の機能が損なわれると、さまざまな疾患が発症し、それぞれ異なる臓器系に影響を及ぼします。

拡張型心筋症1O型(CMD1O)は、心臓の心室が拡張し、収縮機能が低下することで、うっ血性心不全や不整脈を引き起こす疾患です。進行性の病態であり、心機能の低下により早期死亡のリスクが高まる可能性があります。
家族性心房細動12型(ATFB12)は、不整脈の中でも最も一般的な持続性の異常な心拍リズムを引き起こします。この疾患では、心房の電気信号が乱れ、効果的な収縮ができなくなることで、心室への血液供給が不安定になります。動悸や失神(シンコペ)などの症状が見られ、脳梗塞や心不全のリスクも高まるとされています。

多毛性骨軟骨異形成症(HTOCD)は、先天的な多毛症(異常な体毛の増加)、新生児期の過成長(巨人症)、特徴的な骨の異常、心臓の肥大(心肥大)などを引き起こす疾患です。影響を受けた人では、額まで伸びる厚い頭髪や全身の体毛の増加が見られることが多く、顔の特徴として大きな頭(大頭症)、幅広い鼻梁、目頭のひだ(内眼角贅皮)、大きな口、厚い唇などが挙げられます。これらの特徴は、一部の代謝異常疾患と似ていることもあります。
この疾患に罹患した新生児の約半数は、出生時の体重が平均よりも大きく、むくみ(浮腫)が見られることがあります。成長とともに皮下脂肪が少なく、筋肉質な体型になる傾向があります。骨格の異常として、頭蓋骨の肥厚、狭い胸郭、幅広い肋骨、扁平な椎骨、股関節の変形(外反股)、骨密度の低下(骨減少症)、長骨の端(骨幹端)の拡大などが報告されています。また、約80%の症例で心疾患が認められ、動脈管開存症(PDA)、心室肥大、肺高血圧症、心嚢液貯留などが含まれます。さらに、筋緊張低下(低緊張)が見られるため運動発達の遅れがあり、言語の発達もやや遅れる傾向があります。一部の患者では学習障害や知的障害を伴うこともあります。

知的障害およびミオパチー症候群(IDMYS)は、常染色体劣性遺伝(両親から変異遺伝子を受け継ぐことで発症する形式)をとる疾患で、発達の遅れ、軽度の知的障害、筋力低下、疲れやすさなどの症状を引き起こします。多くの患者で筋緊張低下が見られ、脳の白質異常が画像検査で確認されることがあります。また、感音性難聴、特徴的な顔立ち、進行性の心疾患が見られることもあります。
ABCC9遺伝子は、心臓、筋肉、神経系を含む複数の臓器において重要な役割を果たしています。その機能が失われると、ブルガダ症候群やカントゥー症候群などの疾患の特徴が現れることもあります。
これらの疾患の詳細や症状の管理については、「[3_KCNJ8] カントゥー症候群・ブルガダ症候群(Cantú Syndrome; Brugada Syndrome)」の項目をご参照ください。
[5_KRAS] ヌーナン症候群(Noonan Syndrome)


ヌーナン症候群は、主にKRAS遺伝子の変異によって引き起こされる遺伝性疾患です。この遺伝子は、細胞の増殖やシグナル伝達に重要な役割を果たすKRasタンパク質を作る働きを持ちます。KRasタンパク質は、分子スイッチとして機能し、活性化状態(GTP結合状態)と不活性状態(GDP結合状態)を切り替えることで、細胞の正常な機能を維持します。この仕組みは、グアニンヌクレオチド交換因子(GEF)やGTPase活性化タンパク質(GAP)によって厳密に制御されています。しかし、一部の疾患ではこの制御がうまく働かず、異常な細胞増殖や発達の遅れを引き起こすことがあります。ヌーナン症候群や特定のがんは、その代表例です。
ヌーナン症候群の主な特徴として、特有の顔立ち、低身長、先天性心疾患、発達の遅れが挙げられます。その他の症状には、首が広く見える翼状頸、胸郭の変形(鳩胸や漏斗胸)、男性における停留精巣、出血しやすい体質、リンパ系の異常、小児骨髄単球性白血病(JMML)の発症リスクの上昇などがあります。出生時の身長は通常正常ですが、成長が遅れ、最終的な成人身長は低めになる傾向があります。
先天性心疾患は50〜80%の患者に見られ、最も一般的なのは肺動脈弁狭窄症です。肥大型心筋症は20〜30%の患者で発症し、乳児期または小児期に現れることがあります。また、心房中隔欠損症、心室中隔欠損症、肺動脈分枝狭窄症、ファロー四徴症などの心疾患を合併することもあります。心電図異常もよくみられ、心臓の構造に問題がなくても確認されることがあります。

神経発達の程度には個人差があり、一部の人は正常な認知機能を持ちますが、約4分の1の患者に軽度の知的障害がみられます。運動発達の遅れ、言語障害、学習障害もよくみられ、特に言語の発達の遅れは一般的で、言語療法が必要になることがあります。また、注意力の問題や多動、実行機能の課題が多く、場合によっては自閉スペクトラム症に関連する症状がみられることもあります。感情のコントロールが難しく、不安やうつの症状を抱えることもあります。
泌尿生殖器の異常は約11%の患者にみられ、軽度の腎異常が最も一般的です。男性では、停留精巣が60〜80%の頻度で発生し、生殖機能に影響を与えることがありますが、男女ともに一般的には正常な生殖能力を持ちます。

ヌーナン症候群の特徴的な顔立ちは、年齢とともに変化します。乳児期には広い額、離れた目、低く後ろ向きについた耳、短い首、うなじの余分な皮膚が特徴です。思春期には、広い額と尖った顎が目立ち、逆三角形の顔立ちになります。成人では、鼻唇溝が深くなり、皮膚のしわが増えることが多くなります。
骨格異常も多く、脊柱側弯症、椎骨の異常、肘の外反(肘外反)、指が短い(短指症)などが報告されています。歯の問題としては、高口蓋や歯並びの乱れがみられます。また、一部の患者では骨密度が低く、骨減少症のリスクが高まることがあります。

出血しやすい傾向もよく報告され、軽度のあざができやすいものから、手術時の大量出血まで症状の幅は広いです。血小板の機能障害や凝固因子の欠乏がその原因と考えられます。リンパ系の異常もよくみられ、局所的または全身的なリンパ浮腫、乳び胸水、腸・肺・生殖器へのリンパ管拡張症などが含まれます。
眼の問題として、眼瞼下垂、斜視、屈折異常、眼振などが最大95%の患者にみられます。また、約40%の患者が感音性または伝音性難聴を経験し、反復する中耳感染がその要因となることがあります。
皮膚の特徴としては、毛孔性角化症(毛穴の角化異常)、カフェオレ斑、黒色斑(レントギン)などがみられます。これらの皮膚症状は、類似の症候群である心顔皮膚症候群(CFC症候群)と共通することがあります。

ヌーナン症候群の有病率は1,000人に1人から2,500人に1人と推定されています。軽度の症例は診断されないことがあり、報告される頻度にばらつきがある可能性があります。この疾患は通常、常染色体優性遺伝によって受け継がれますが、一部は新生突然変異によるものです。KRAS遺伝子のほか、PTPN11、BRAF、RAF1、SOS1など、細胞の成長や分化を調整するRas/MAPKシグナル伝達経路に関与する複数の遺伝子の変異が原因となることが知られています。これらの遺伝子の変異によりシグナル伝達が過剰に活性化し、本症候群の特徴的な症状が現れます。
診断は臨床的な特徴を基に行われ、遺伝子検査によって確定されます。治療は合併症の管理が中心となり、先天性心疾患に対する外科的治療、早期の発達支援、個別の教育プランの提供などが行われます。成長ホルモン療法は、成長ホルモン分泌の異常がある患者の身長改善に使用されることがあります。また、心血管の健康、成長、神経発達、出血リスクを定期的に監視することが推奨されます。PTPN11またはKRAS遺伝子の変異を持つ患者は、JMMLやその他の悪性腫瘍のリスクがあるため、定期的なスクリーニングが必要です。

遺伝カウンセリングは、患者やその家族に推奨されます。既知の病的変異を持つ家族は、出生前または着床前遺伝診断を検討することができます。
引用文献
- Roberts AE. Noonan Syndrome. 2001 Nov 15 [Updated 2022 Feb 17]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1124/
- Simanshu, D. K., Nissley, D. V., & McCormick, F. (2017). RAS Proteins and Their Regulators in Human Disease. Cell, 170(1), 17–33. https://doi.org/10.1016/j.cell.2017.06.009
- Roberts AE. Noonan Syndrome. 2001 Nov 15 [Updated 2022 Feb 17]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1124/
- Grange DK, Nichols CG, Singh GK. Cantú Syndrome. 2014 Oct 2 [Updated 2020 Oct 1]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK246980/
- Brugada R, Campuzano O, Sarquella-Brugada G, et al. Brugada Syndrome. 2005 Mar 31 [Updated 2022 Aug 25]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK1517/
- Shapiro, S. M. (2003). Bilirubin toxicity in the developing nervous system. Pediatric Neurology, 29(5), 410–421. https://doi.org/10.1016/j.pediatrneurol.2003.09.011
- Hansen T. W. (2001). Bilirubin brain toxicity. Journal of perinatology : official journal of the California Perinatal Association, 21 Suppl 1, S48–S62. https://doi.org/10.1038/sj.jp.7210634
- Jirsa M, Knisely AS, Schinkel A, et al. Rotor Syndrome. 2012 Dec 13 [Updated 2019 Jul 11]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2025. Available from: https://www.ncbi.nlm.nih.gov/books/NBK114805/
- Zawerton, A., Mignot, C., Sigafoos, A., Blackburn, P. R., Haseeb, A., McWalter, K., Ichikawa, S., Nava, C., Keren, B., Charles, P., Marey, I., Tabet, A. C., Levy, J., Perrin, L., Hartmann, A., Lesca, G., Schluth-Bolard, C., Monin, P., Dupuis-Girod, S., Guillen Sacoto, M. J., … Depienne, C. (2020). Widening of the genetic and clinical spectrum of Lamb-Shaffer syndrome, a neurodevelopmental disorder due to SOX5 haploinsufficiency. Genetics in medicine : official journal of the American College of Medical Genetics, 22(3), 524–537. https://doi.org/10.1038/s41436-019-0657-0
- Lian, R., Wu, G., Xu, F., Zhao, S., Li, M., Wang, H., Jia, T., & Dong, Y. (2024). Clinical cases series and pathogenesis of Lamb-Shaffer syndrome in China. Orphanet journal of rare diseases, 19(1), 281. https://doi.org/10.1186/s13023-024-03279-7
- Tenorio-Castano, J., Gómez, Á. S., Coronado, M., Rodríguez-Martín, P., Parra, A., Pascual, P., Cazalla, M., Gallego, N., Arias, P., Morales, A. V., Nevado, J., & Lapunzina, P. (2023). Lamb-Shaffer syndrome: 20 Spanish patients and literature review expands the view of neurodevelopmental disorders caused by SOX5 haploinsufficiency. Clinical genetics, 104(6), 637–647. https://doi.org/10.1111/cge.14423
- Perez, G., Barber, G. P., Benet-Pages, A., Casper, J., Clawson, H., Diekhans, M., Fischer, C., Gonzalez, J. N., Hinrichs, A. S., Lee, C. M., Nassar, L. R., Raney, B. J., Speir, M. L., van Baren, M. J., Vaske, C. J., Haussler, D., Kent, W. J., & Haeussler, M. (2024). The UCSC Genome Browser database: 2025 update. Nucleic Acids Research, gkae974. https://doi.org/10.1093/nar/gkae974
- Harrison, P. W., Amode, M. R., Austine-Orimoloye, O., Azov, A. G., Barba, M., Barnes, I., Becker, A., Bennett, R., Berry, A., Bhai, J., Bhurji, S. K., Boddu, S., Branco Lins, P. R., Brooks, L., Budhanuru Ramaraju, S., Campbell, L. I., Carbajo Martinez, M., Charkhchi, M., Chougule, K., … Yates, A. D. (2024). Ensembl 2024. Nucleic Acids Research, 52(D1), D891–D899. https://doi.org/10.1093/nar/gkad1049
 中文
中文