アンドロゲン性脱毛症(AGA)は、男性ホルモン「テストステロン」が「ジヒドロテストステロン(DHT)」に変換されることで起こります。この変換を促す酵素「5αリダクターゼ」には複数のタイプがあり、特にSRD5A1、SRD5A2がAGAの原因として重要です。また近年、天然由来のカボチャ種子油も注目され、副作用が少ない新たな治療の可能性が期待されています。本記事ではAGAのメカニズムを分かりやすく解説します。
アンドロゲン性脱毛症(Androgenetic Alopecia)の原因と病態メカニズム
アンドロゲン性脱毛症(AGA)は、主に男性ホルモン(アンドロゲン)の作用が原因となって起こる脱毛症です。このAGAの発症には、「5αリダクターゼ(5α-還元酵素)」という酵素が重要な役割を担っています。5αリダクターゼは体内のさまざまな組織や臓器に存在しており、性腺(精巣や卵巣)、副腎、中枢神経系(Central Nervous System, CNS)などで作られたステロイドホルモンの前駆物質を、より活性が高いステロイドホルモンに変換する働きを持っています。
5αリダクターゼの種類と役割について
5αリダクターゼのグループには、主に5つの酵素があります。そのうち3つ(SRD5A1、SRD5A2、SRD5A3)はステロイドホルモンの変換に関与しており、残りの2つ(TECRおよびTECR-like)は働きがまだ完全には解明されていません。SRDという名前は、ステロイド5αリダクターゼ(Steroid 5-alpha Reductase)の略称です。
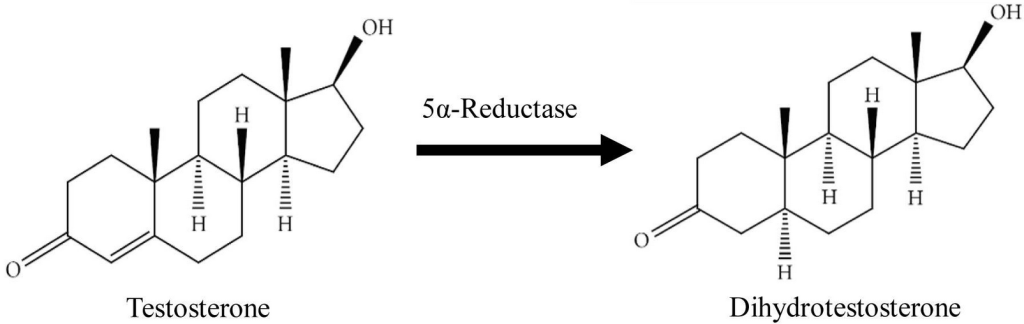
5-α-還元酵素によるテストステロン(T)からジヒドロテストステロン(DHT)への変換。
SRD5A1、SRD5A2、SRD5A3はそれぞれ別々の遺伝子によってコードされており、性質や体内での分布が異なりますが、いずれもテストステロン(Testosterone, T)という男性ホルモンを、より活性の高いジヒドロテストステロン(Dihydrotestosterone, DHT)に変換することができます。
DHTの重要性とAGAへの影響
ジヒドロテストステロン(DHT)は、テストステロンよりも5倍も強くアンドロゲン受容体(Androgen Receptor, AR)に結合し、男性ホルモンによって活性化される遺伝子を誘導する力が10倍も高くなっています。このため、DHTは特定の組織で男性ホルモンの影響を増幅させる重要な役割を果たします。
AGAの進行に関わる遺伝子には、トランスフォーミング成長因子β1(Transforming Growth Factor-beta 1, TGF-β1)、インターロイキン6(Interleukin-6, IL-6)、ディックコフ1(Dickkopf-1, DKK1)などがあります。これらの遺伝子は男性ホルモンによって誘導され、髪の毛の成長を抑制する働きを持っているため、AGAの進行に深く関与しています。

SRD5A酵素の体内分布とAGAとの関連性
SRD5A酵素は、副腎、精巣、胎盤、そして特に皮膚など、男性ホルモンの影響を受けるさまざまな組織で発現しています。SRD5Aの遺伝子から作られるタンパク質は、主に細胞内の小胞体(Endoplasmic Reticulum, ER)の膜に存在しています。
AGAに特に重要なのは、SRD5A1とSRD5A2という2種類の酵素です。これらは、皮膚や皮膚付属器官(毛包、皮脂腺、汗腺)に多く存在し、AGAのある人では額部分の毛包(髪をつくる組織)での発現量が特に高くなっています。これは、SRD5A1とSRD5A2がAGAの主要な原因の一つであることを示しています。特にSRD5A2は、AGA患者の頭皮の毛乳頭細胞(Dermal Papilla Cells, DPC)で他の部位よりも高く発現していることが報告されています。


SRD5A3の役割とAGAにおける可能性
SRD5A3という酵素は、タンパク質のN型糖鎖付加(N-グリコシル化)という別の機能を主に持ち、ステロイドの変換にはほとんど関わっていないと考えられています。しかし、ある研究では、SRD5A3の発現を抑制すると、細胞内でDHTがテストステロンに対して相対的に減少することが報告されており、間接的にステロイド代謝に影響を与える可能性も指摘されています。
また、SRD5A3はSRD5A1やSRD5A2と比較すると、皮膚を含む末梢の組織での発現量が高いことが分かっています。さらに、SRD5A3の発現は前立腺がんで高くなっており、前立腺がんとAGAには何らかの関連性があるのではないかと示唆する研究もいくつかあります。AGA患者の髪の毛から採取された細胞でもSRD5A3の発現が高くなっていることが確認されており、SRD5A3がAGAの発症にも何らかの形で関与している可能性が考えられています。

男性型脱毛症(AGA)の原因や進行:5αリダクターゼ酵素
特にSRD5A1とSRD5A2は、テストステロンを強力なDHTへと変換することによって男性ホルモンの作用を増幅させ、髪の毛の成長を抑制し、脱毛を促進しています。また、SRD5A3も直接的なステロイド変換は少ないながら、AGAと関連がある可能性が研究されています。これらの酵素の作用を詳しく理解することが、AGAの治療や予防のためにも重要です。

治療薬:フィナステリド(Finasteride)およびデュタステリド(Dutasteride) について
経口フィナステリドおよびデュタステリドは、「男性型脱毛症(Androgenetic Alopecia:AGA)」の治療薬として広く承認されており、病院でも一般的に処方されています。これらの薬は「5α還元酵素(5-alpha reductase:5-AR)」という酵素の働きを競合的に阻害する作用を持っています。この酵素は、男性ホルモンの一種であるテストステロンを、より強力な作用を持つ「ジヒドロテストステロン(Dihydrotestosterone:DHT)」へと変換する働きをしており、DHTは上述の通り、脱毛を引き起こす主な原因の一つです。
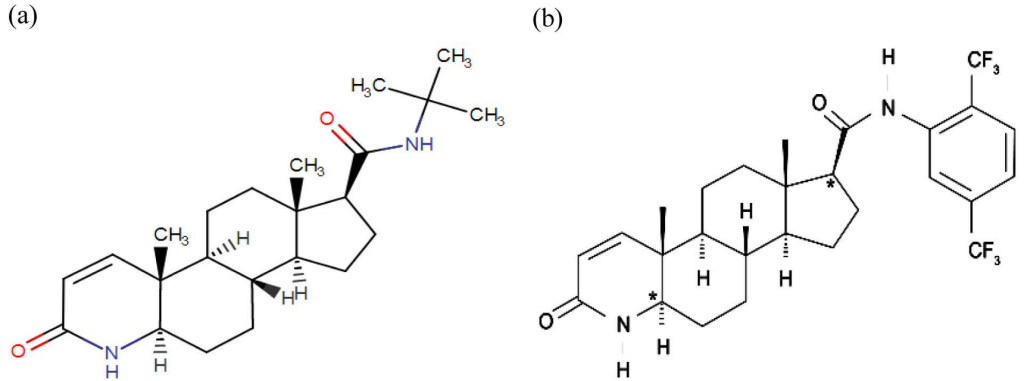
5αRisの化学構造。(a)フィナステリド、(b)ダスタステリド。
フィナステリドは、主に3種類存在する5α還元酵素のうち、「タイプ2(SRD5A2)」という種類を選択的に阻害します。また、それよりはやや弱いながらも「タイプ3(SRD5A3)」にも作用しますが、「タイプ1(SRD5A1)」に対してはほとんど作用しません。一方で、デュタステリドは、これら3種類の5α還元酵素すべてを強力に阻害するため、より幅広い作用があるとされています。また、薬剤が体内で半分の量にまで減少するのにかかる時間(半減期)がデュタステリドの方がはるかに長く、フィナステリドの半減期が6~8時間なのに対し、デュタステリドは4~5週間と、体内に長く留まりやすい特徴があります。

3-オキソ-5-アルファ-ステロイド 4-デヒドロゲナーゼ 1(3-oxo-5-alpha-steroid 4-dehydrogenase 1)
これらの経口5α還元酵素阻害薬(5-alpha reductase inhibitors:5-ARIs)は、AGA治療薬としての効果が医学的に証明されていますが、一方で副作用の問題も知られています。その代表的な副作用として、勃起不全(ED)や性欲の減退などが挙げられ、これが原因で治療を途中で断念する患者さんも少なくありません。そこで、副作用を軽減できる可能性のある方法として、頭皮に直接薬剤を塗布するタイプの「外用薬」としての使用も研究されてきました。外用タイプの5-ARIsでも血液中のDHT濃度を大幅に減少させることができ、減少の程度は経口薬とほぼ同じ水準に達することもあります(外用薬で約68~75%、経口薬で約62~72%の減少)。
具体的な研究例として、成人男性323名を対象とした24週間のランダム化比較試験では、外用フィナステリドは経口フィナステリドと同程度の効果を示しました。ここでの効果は「目標部位の毛髪数(Target Area Hair Count:TAHC)」の改善によって評価されています。ただし、外用薬ではフィナステリドの血中濃度の最大値(ピーク値)が低く、初期の血液中DHT濃度の減少が比較的緩やかであるため、副作用のリスクが経口薬よりも抑えられる可能性があります。また別の試験では、フィナステリド(0.25%)を外用ミノキシジル(3%)と併用した場合、ミノキシジル単独と比較して、24週間後に髪の密度や太さが大きく改善されました。これらの結果から、外用フィナステリドとミノキシジルの併用には相乗的な効果(お互いの効果を高め合う作用)があることが示されています。

女性患者においては、経口フィナステリドは使用が難しい場合があります。これは、薬剤によっては「多毛症(顔や体の毛が増える)」や「月経不順」などの副作用が起こり得るためです。そのため、女性患者にとっても、より安全な選択肢として外用フィナステリドが検討されています。ある研究では、閉経後の女性30名を対象として、外用フィナステリド(0.25%)とミノキシジル(3%)を組み合わせて使用したところ、ミノキシジル単独と比べ、髪の密度や太さに改善が見られました。ただし、この分野の研究はまだ十分に多くなく、研究ごとの結果にもばらつきがあるため、女性における外用5-ARIsの一般的な効果や安全性については、まだ確かな結論が出ていません。また女性の脱毛症の場合、原因がさまざまで複雑であるため、治療法の有効性も慎重に検討される必要があります。
さらに、2024年に行われた「メタアナリシス(さまざまな研究の結果を統計的に統合・分析する手法)」によると、男性型脱毛症の治療法としては、経口5-ARIsが依然としてミノキシジル、ボツリヌス毒素(ボトックス)、マイクロニードリング(細かい針を使った施術)、光治療(フォトバイオモジュレーション)などの代替治療よりも、単独の薬剤としては効果が高いことが分かっています。しかし、経口薬は長期的な副作用の問題があるため、副作用の少ない外用薬や、薬草由来の抽出物など、より安全で使いやすい代替治療への関心が高まっています。

カボチャ、ペポ
Cucurbita pepo L. ククルビタ ペポ L
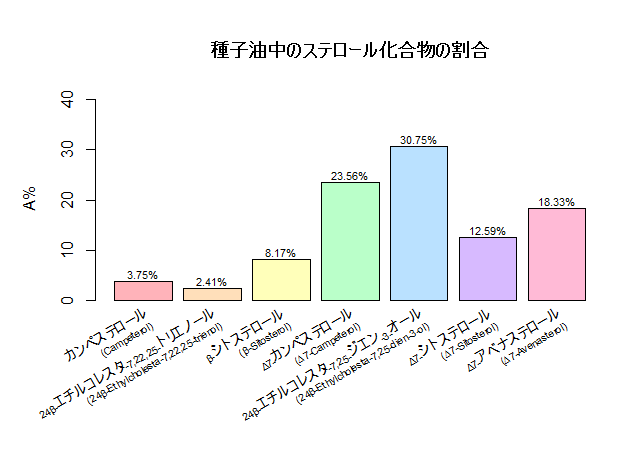
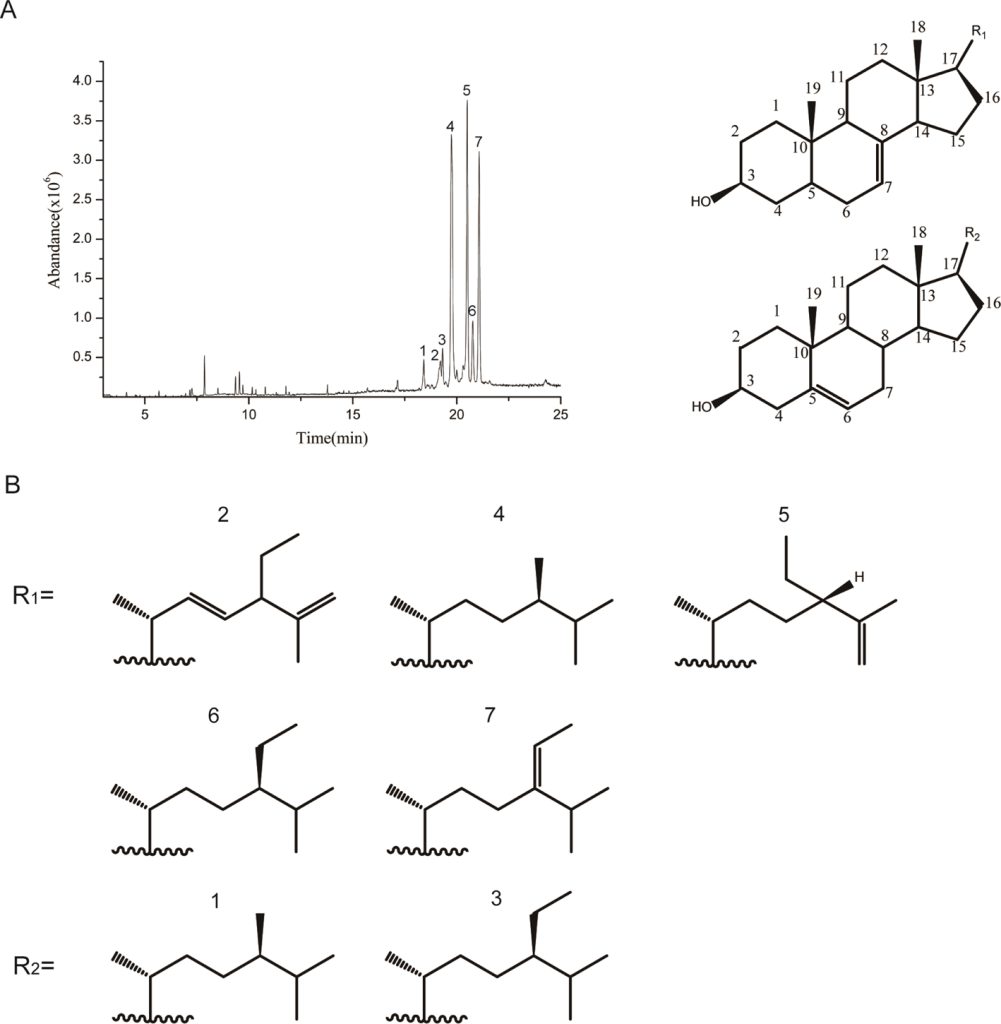
カボチャ種子油(Pumpkin seed oil、略称:PSO)は、ペポカボチャ(学名:Cucurbita pepo L.)の楕円形の種子から抽出される天然の植物油で、特に「男性型脱毛症」(androgenetic alopecia、略称:AGA)という遺伝性の脱毛症状に対し、効果が期待されています。PSOが脱毛の改善に役立つ理由は、その中に豊富に含まれる植物由来の有効成分が関係しています。主な成分には「フィトステロール」(植物ステロール)と呼ばれる天然化合物群(例:デスモステロール、カンペステロール、スチグマステロール、β-シトステロール、スピナステロール、∆7-フィトステロールなど)や、ポリフェノール類、トコフェロール(ビタミンE群)、スクアレン、そしてオレイン酸やリノール酸などの重要な不飽和脂肪酸があります。これらが複合的に作用することで、脱毛や前立腺疾患に深く関わる「5αリダクターゼ」(5-alpha reductase、略称:5αR)という酵素の働きを抑制します。この酵素は体内で男性ホルモンを活性化する役割があり、AGAや前立腺肥大の原因の一つとされています。
医薬品として一般的に使われる「5αリダクターゼ阻害薬」(5-alpha reductase inhibitors、略称:5αRis)の代表的なものには、フィナステリドという薬剤があります。フィナステリドはAGAや前立腺疾患の治療に効果的ですが、副作用として性機能障害(勃起不全や射精障害、性欲低下)や頭痛、胃腸の不調などが起こることがあります。また、フィナステリドなどの医薬品は、軽度な前立腺がんの予防につながる可能性がある一方で、進行が速く治療が困難な重症度の高い前立腺がんの発生を促すリスクがあるという議論もあり、安全性に懸念が持たれています。
こうした副作用への不安から、より安全で穏やかな作用を持つ植物由来の代替品への関心が高まっています。その中でもカボチャ種子油は、臨床研究で実際にその効果や安全性が認められつつあります。特に注目された研究では、軽度~中程度のAGAを持つ男性76人に対し、PSOを1日400mgずつ、24週間飲んでもらう臨床試験が行われました。この試験は、対象者が治療を受けているか偽薬(プラセボ)を飲んでいるかわからないようにする「二重盲検法」と呼ばれる方法で行われました。その結果、PSOを摂取したグループでは、プラセボに比べて自己評価による満足度が高まり、髪の毛の本数も平均で40%増加したのに対し、プラセボのグループでは10%にとどまりました。また、副作用の発生頻度はプラセボ群と差がなく、フィナステリドのような性機能障害の報告もありませんでした。

さらに2020年には、「女性型脱毛症」(female pattern hair loss、略称:FPHL)の女性を対象とした研究も行われています。この研究では、カボチャ種子油を頭皮に直接塗る方法と、現在広く使われているミノキシジル5%泡状製剤の効果を3ヶ月間比較しました。その結果、両グループとも髪の太さや質の多様性が改善し、細く弱い毛(軟毛)が減少しました。特にPSOを使用したグループでは新しく立ち上がる毛髪の数が明らかに増え、脱毛症への有効性が期待できることが示されました。ただし、さらに規模の大きな研究が必要だとされています。
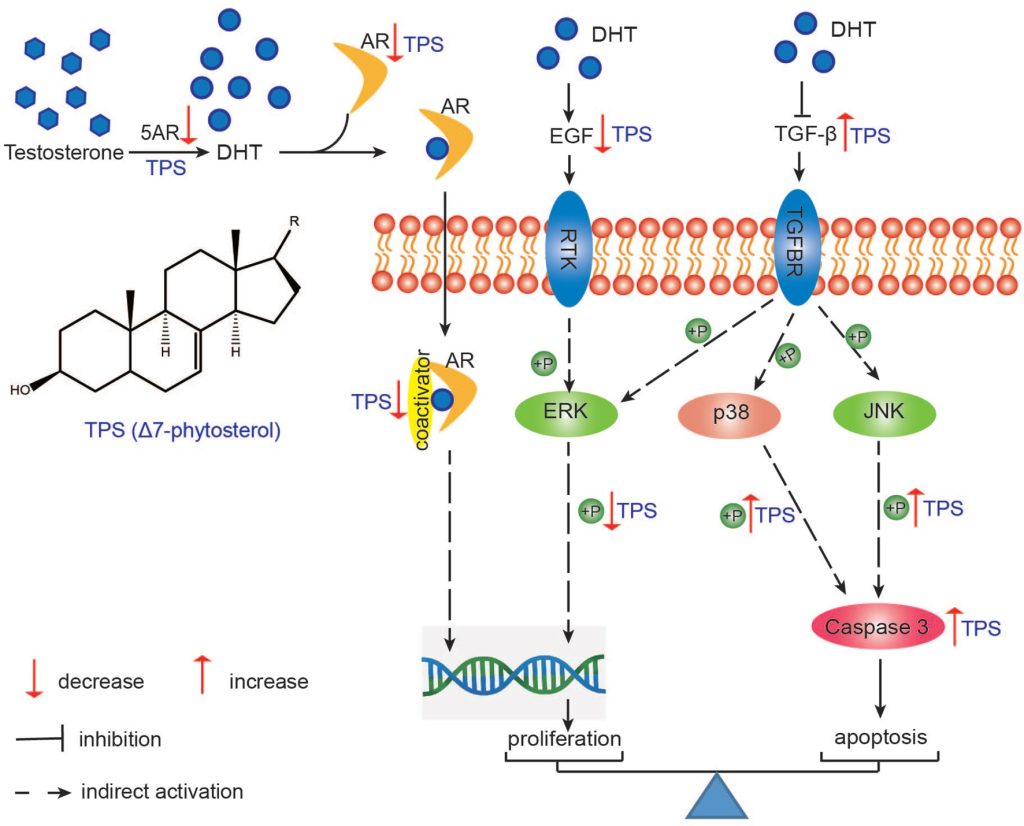
PSOがなぜ効果を発揮するかというメカニズムの研究も進んでいます。中心的な作用は5αリダクターゼの抑制ですが、それ以外にも炎症を抑える作用(抗炎症作用)や、細胞にダメージを与える活性酸素を消去する作用(抗酸化作用)も関係しています。具体的には、カボチャ種子に含まれるフィトステロールが、脱毛や前立腺肥大の原因となる男性ホルモンの作用を抑制したり(アンドロゲン受容体(AR)およびSRC-1というタンパク質の発現を抑える)、細胞の過剰な増殖を抑制する(ERKのリン酸化を減少させる)ほか、細胞が自然に死ぬ仕組み(アポトーシス)を促進する作用(JNKおよびp38経路を通じてCaspase-3という酵素を活性化する)が指摘されています。
さらに、前立腺肥大症(benign prostatic hyperplasia、略称:BPH)や過活動膀胱の患者を対象とした研究でも、カボチャ種子から抽出した成分の安全性や有効性が確認されています。例えば、前立腺肥大症の男性53人を対象としたランダム化二重盲検試験では、カボチャ種子エキスとノコギリヤシを組み合わせた製剤(Curbicin)によって、排尿時の尿の勢いや頻尿、残尿感が改善され、副作用の報告もありませんでした。
このように、カボチャ種子油およびその有効成分であるフィトステロールは、AGAや前立腺肥大症など男性ホルモンが関係する疾患に対し、安全で効果的な治療法となる可能性があります。ただし、詳細な作用メカニズムの解明や長期的な有効性を確認するためには、今後さらなる研究が必要です。現時点では、カボチャ種子油は従来の医薬品に比べ、副作用が少ない天然の代替または補助療法として大きな期待が寄せられています。

ハム〇郎みたいにかぼちゃの種を食べまくるのは本当に効果的なのか?
かぼちゃの種に含まれる生理活性成分(bioactive components)が、実際に体内でどのような仕組みで働き(作用機序:mechanism of action)、どれくらいの量を摂取すれば十分な効果が得られるのかについては、さらに詳細で長期的な研究が必要です。ここで言う「生理活性成分」とは、人の体に何らかの良い影響を与える可能性がある成分を指しますが、その働きを明らかにするためには、長期間にわたる研究や調査を重ねる必要があります。

また、かぼちゃの種を普段の食生活に取り入れるだけでは、AGA(男性型脱毛症:androgenic alopecia)を完全に治療したり、医学的に意味のあるほどの大きな改善効果を得たりすることは難しいでしょう。AGAは主に男性に多く見られる薄毛や脱毛症状の一種で、男性ホルモンが関与して起きるとされています。かぼちゃの種を食べることで健康に良い影響をもたらす可能性はありますが、現段階では、食事に取り入れる程度の量ではAGAへの劇的な治療効果は期待できません。
しかし、かぼちゃの種を食べること自体には、通常、副作用などの健康リスクはほとんどなく、栄養価の高い健康的な間食としても適しています。

今後、研究が進むにつれて、かぼちゃの種や、植物由来の別の成分を利用した新しい治療方法が登場する可能性があります。現時点では明確な治療効果が確認されていなくても、将来的には植物由来の成分を活用した新しいAGA治療法が確立されることも期待されているのです。
薄毛で悩んでますが...

FUE法(毛包単位摘出法)は、男性型脱毛症(AGA)の治療において広く認められている効果的な植毛技術のひとつです。AGAは「アンドロゲン性脱毛症(Androgenetic Alopecia)」の略で、遺伝や男性ホルモンの影響で起こる一般的な脱毛症のことを指します。FUE法は、他の治療法で十分な効果が得られなかった患者にも特に効果が高い方法として知られています。
従来の植毛手術には、頭皮から帯状に皮膚を切り取って移植用の毛包を採取する方法(リニア・ストリップ法、Linear Strip Excision: LSE)がありますが、FUE法では頭皮から直接、一つひとつの毛包単位を手作業、機械、またはロボットを使って摘出します。この方法によって、手術による傷や身体への負担が大幅に軽減され、回復期間も短縮される上、LSE法で起きる帯状の線状の傷跡(ドナー傷)を残さずに済みます。そのため、特に短いヘアスタイルを好む人や手術跡を目立たせたくない人に人気があり、ここ20年間で世界的にも急速に普及しています。

植毛手術の長期的な結果を調べた研究では、施術から10年以上経過した患者でも、高い満足度が一貫して報告されています。70名の患者を対象としたある後ろ向き調査(過去に行われた手術結果を分析する研究)では、患者の満足度が脱毛治療薬、特にフィナステリドという飲み薬を継続して使用するかどうかに大きく影響されることが示されました。興味深いことに、この研究では、移植後の髪の毛の密度が5年間でおよそ4~6%ほど減少することもわかりました。これは、通常「安全」とされるドナー部位(移植用に採取した頭皮部分)から取った毛包であっても、必ずしも永久的に髪を維持できるわけではないことを示しています。ただ、術後10年を経ても、移植部位と元のドナー部位の髪の毛の太さ(毛髪の直径)には大きな違いは見られませんでした。
また、女性の患者を対象にした研究でも、植毛後10年以上経った時点で髪の毛の減少が比較的安定していることが報告されていますが、調査対象となった人数が少なかったため、さらなる調査が必要です。

これらの結果をさらに裏付ける最近の研究として、エジプトのメヌフィア大学病院で2019年6月から2021年10月の間に実施された前向きコホート研究(ある一定期間において特定の治療を受けた患者を継続的に観察する研究)があります。この研究では、実際にFUE法で植毛手術を受けた患者の満足度が評価され、約90%の患者が術後の見た目に大きく改善を感じており、自分自身が以前よりも若返ったように感じていることが明らかになりました。満足度は「FACE-Q」という評価尺度を使って客観的に測定され、FUE法がAGA患者の心理面にも良い影響を与えることが確認されました。
以上のことから、FUE法はAGAの長期的な治療法として広く選ばれるようになり、特にフィナステリドなどの薬剤を継続して服用することで、高い患者満足度が持続すると考えられています。ただし、時間が経つにつれて髪の密度がわずかずつ減少する傾向があるため、良い結果を長く保つためには、薬の服用を継続するなど患者自身が治療にしっかり取り組むことが重要です。今後さらに多くの患者を対象とした、より長期間の追跡調査を行うことで、これらの結果をさらに詳しく確認し、より良い治療法につなげていく必要があるでしょう。

キーワード
アンドロゲン性脱毛症, AGA, 男性型脱毛症, 薄毛治療, 5αリダクターゼ, SRD5A1, SRD5A2, ジヒドロテストステロン, DHT, フィナステリド, デュタステリド, テストステロン, カボチャ種子油, フィトステロール, ミノキシジル, 外用フィナステリド, 男性ホルモン, 毛包, 抗酸化作用, 植毛, ヒロクリニック
引用文献
- Gupta, A. K., Bamimore, M. A., Wang, T., & Talukder, M. (2024). The impact of monotherapies for male androgenetic alopecia: A network meta-analysis study. Journal of cosmetic dermatology, 23(9), 2964–2972. https://doi.org/10.1111/jocd.16362
- Salisbury BH, Leslie SW, Tadi P. 5α-Reductase Inhibitors. [Updated 2024 Jun 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK555930/
- Escamilla-Cruz, M., Magaña, M., Escandón-Perez, S. et al. Use of 5-Alpha Reductase Inhibitors in Dermatology: A Narrative Review. Dermatol Ther (Heidelb) 13, 1721–1731 (2023). https://doi.org/10.1007/s13555-023-00974-4
- Gene group | hugo gene nomenclature committee. (n.d.). Retrieved March 18, 2025, from https://genenames.org/data/genegroup/#!/group/1967
- Han, Y., Zhuang, Q., Sun, B. et al. Crystal structure of steroid reductase SRD5A reveals conserved steroid reduction mechanism. Nat Commun 12, 449 (2021). https://doi.org/10.1038/s41467-020-20675-2
- The UniProt Consortium, UniProt: the Universal Protein Knowledgebase in 2025, Nucleic Acids Res. 53:D609–D617 (2025)
- Waterhouse, A., Bertoni, M., Bienert, S., Studer, G., Tauriello, G., Gumienny, R., Heer, F.T., de Beer, T.A.P., Rempfer, C., Bordoli, L., Lepore, R., Schwede, T. SWISS-MODEL: homology modelling of protein structures and complexes. Nucleic Acids Res. 46(W1), W296-W303 (2018).
- Guex, N., Peitsch, M.C., Schwede, T. Automated comparative protein structure modeling with SWISS-MODEL and Swiss-PdbViewer: A historical perspective. Electrophoresis 30, S162-S173 (2009).
- Bienert, S., Waterhouse, A., de Beer, T.A.P., Tauriello, G., Studer, G., Bordoli, L., Schwede, T. The SWISS-MODEL Repository – new features and functionality. Nucleic Acids Res. 45, D313-D319 (2017).
- P18405 | swiss-model repository. (n.d.). Retrieved March 18, 2025, from https://swissmodel.expasy.org/repository/uniprot/P18405?csm=AEF9FD5521E43AC4
- Azzouni, F., Godoy, A., Li, Y., & Mohler, J. (2012). The 5 alpha-reductase isozyme family: A review of basic biology and their role in human diseases. Advances in Urology, 2012, 1–18. https://doi.org/10.1155/2012/530121
- Khantham, C., Yooin, W., Sringarm, K., Sommano, S. R., Jiranusornkul, S., Carmona, F. D., Nimlamool, W., Jantrawut, P., Rachtanapun, P., & Ruksiriwanich, W. (2021). Effects on Steroid 5-Alpha Reductase Gene Expression of Thai Rice Bran Extracts and Molecular Dynamics Study on SRD5A2. Biology, 10(4), 319. https://doi.org/10.3390/biology10040319
- Ibrahim, I. M., Hasan, M. S., Elsabaa, K. I., & Elsaie, M. L. (2021). Pumpkin seed oil vs. minoxidil 5% topical foam for the treatment of female pattern hair loss: a randomized comparative trial. Journal of Cosmetic Dermatology, 20(9), 2867-2873. https://doi.org/10.1111/jocd.13976
- Hamilton, R. J., & Freedland, S. J. (2011). 5-α reductase inhibitors and prostate cancer prevention: where do we turn now?. BMC medicine, 9, 105. https://doi.org/10.1186/1741-7015-9-105
- Cho, Y. H., Lee, S. Y., Jeong, D. W., Choi, E. J., Kim, Y. J., Lee, J. G., Yi, Y. H., & Cha, H. S. (2014). Effect of pumpkin seed oil on hair growth in men with androgenetic alopecia: a randomized, double-blind, placebo-controlled trial. Evidence-based complementary and alternative medicine : eCAM, 2014, 549721. https://doi.org/10.1155/2014/549721
- Carbin, B. E., Larsson, B., & Lindahl, O. (1990). Treatment of benign prostatic hyperplasia with phytosterols. British journal of urology, 66(6), 639–641. https://doi.org/10.1111/j.1464-410x.1990.tb07199.x
- Ramak, P., & Mahboubi, M. (2019). The beneficial effects of Pumpkin (cucurbita pepo l.) seed oil for health condition of men. Food Reviews International, 35(2), 166–176. https://doi.org/10.1080/87559129.2018.1482496
- Gossell-Williams, M., Davis, A., & O’Connor, N. (2006). Inhibition of testosterone-induced hyperplasia of the prostate of sprague-dawley rats by pumpkin seed oil. Journal of Medicinal Food, 9(2), 284–286. https://doi.org/10.1089/jmf.2006.9.284
- Kinter KJ, Amraei R, Anekar AA. Biochemistry, Dihydrotestosterone. [Updated 2023 Jul 30]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK557634/
- Kang, X., Chen, T., Zhou, J., Shen, P., Dai, S., Gao, C., Zhang, J., Xiong, X., & Liu, D. (2021). Phytosterols in hull-less pumpkin seed oil, rich in ∆7-phytosterols, ameliorate benign prostatic hyperplasia by lowing 5α-reductase and regulating balance between cell proliferation and apoptosis in rats. Food & Nutrition Research, 65. https://doi.org/10.29219/fnr.v65.7537
- Orentreich, N. (1959). Autografts in alopecias and other selected dermatological conditions. Annals of the New York Academy of Sciences, 83(3), 463–479. https://doi.org/10.1111/j.1749-6632.1960.tb40920.x
- Konstantinos, A. (2024). Hair Transplantation—From the “Ancient” 4 mm Plugs to the Latest Follicular Unit Excision Technique: 8 Decades of Painful Progress. In: Panagotacos, P.J., Maibach, H. (eds) Hair Loss. Updates in Clinical Dermatology. Springer, Cham. https://doi.org/10.1007/978-3-031-74314-6_3
- Pathomvanich, D., & Mella, C. A. (2023). A ten-year retrospective analysis on the long-term survival of hair transplants. International Society of Hair Restoration Surgery, 33(5), 157–165. https://doi.org/10.33589/33.5.157
- Elsakka, D., ElKhesy, M., & Gaber, M. (2022). Efficacy and evaluation of hair transplantation in patients with androgenic alopecia. Menoufia Medical Journal, 35(3), 1043–1049. https://doi.org/10.4103/mmj.mmj_15_22